Gase Prüfung 3 und Problemlösungen
Gase Prüfung 3 und Problemlösungen
1. Finden Sie ein Volumen von 0,5 mol CH4 unter einem Druck von 3,28 atm und einer Temperatur von 400 ° K.
Lösung: P=3,28 atm, n=0,5mol, T=400 0K, R=0,082, V=?
Wir wenden das ideale Gasgesetz an.
P.V=n.R.T
3,28.V=0,5.0,082.400
V = 5 Liter
2. Wenn 6,4 g CH4 einen Druck von 0,5 atm und ein Volumen von 2 Litern haben, finden Sie einen Druck von 9 g C2H6 mit einem Volumen von 1 Liter bei konstanter Temperatur. (C = 12, H = 1)
Lösung:
Wir finden zuerst Mol gegebener Dinge; nCH4=6,4/16=0,4mol
nC2H6=9/30=0,3mol
Da die Temperatur konstant ist, schreiben wir das unten angegebene ideale Gasgesetz.
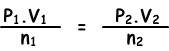
(0,5.2)/0,4=(P2.1)/0,3
P2=0,75 atm
or P2= 57 cm Hg
3. Bestimmen Sie die Dichte von O2 bei einer Temperatur von 27 ° C und einem Druck von 1,23 atm. (O = 16)
Lösung: T=27 + 273=300 0K
Wenn wir das ideale Gasgesetz für die Dichte schreiben, erhalten wir folgende Gleichung;
d=(P.M)/(R.T)
worin M die Molmasse von O2 ist. d=(1,23.32)/(0,082.300)
d=1,6g/Liter
4. Wenn wir die in der Abbildung unten gezeigten Hähne öffnen, ermitteln Sie die Endtemperatur der Gase.

Lösung:
Wir verwenden die folgende Gleichung, um den Enddruck des Gasgemisches zu ermitteln. P1.V1 + P2.V2 + P3.V3 = Pfinale.Vfinale
3.2 + 4.3 + 0.5 =Pfinale.(2+3+5)
6 + 12=Pfinalel.10
Pfinale=1,8 atm
5. Wenn wir die im Bild unten gezeigten Hähne öffnen, stellen Sie fest, dass sich der Gasdruck ändert.

Lösung:
Wir sollten den endgültigen Druck des Systems finden, um Vergleiche anzustellen. P1.V1 + P2.V2 + P3.V3 = Pfinale.Vfinale
P.V + 2P.2V + 3P.V = Pfinale.(V+2V+V)
Pfinale=2P
Somit,
I. Druck des ersten Behälters steigt an
II. Der Druck des zweiten Behälters bleibt konstant
III. Der Druck des dritten Behälters nimmt ab