Chemische Bindungen
Chemische Bindungen
Bindungen
Die Kraft, Atome und Moleküle zusammenzuhalten, nennt man Bindung. Atome kommen zusammen und werden stabiler und Energie wird während dieses Prozesses freigesetzt. Wir können also sagen, dass alle Bindungsreaktionen exotherm sind. Im Gegenteil, alle Bindungsbruchreaktionen sind endotherm. Valenzelektronen von Atomen und Molekülen spielen eine Rolle bei der Bindung. Wenn eine Bindung Atome zusammenhält, nennen wir sie chemische Bindung. Wenn jedoch Bindungsmoleküle aneinander binden, nennen wir dies molekulare Bindung.
Chemische Bindungen:
Es gibt zwei Arten chemischer Bindungen.
- Ionenverbindung
- Kovalente Bindung
Während Elemente Verbindungen bilden, neigen sie dazu, eine Elektronenkonfiguration von Edelgasen aufzuweisen. Mit Ausnahme von He beenden alle Edelgase ihre Elektronenkonfiguration mit ns2 np6. Mit anderen Worten, alle Schalen von Edelgasen sind gefüllt. Sie sind zu stabil. Atome wollen auch stabil sein und ihre Valenzelektronenzahl auf 8 vervollständigen.
Lewis-Strukturen von Atomen
Darstellungen des Valenzelektronens um Symbol von Elementen mit Punkten. Zum Beispiel; 11Na=1s22s22p63s1
Wie Sie sehen können, hat Na ein Valenzelektron in seiner äußersten Schale. Wir zeigen es mit der Lewis Formel;
Na ●
Wenn andererseits 1s, 2s und 2p Orbitale voll sind, werden sie nicht mit der Lewis-Formel dargestellt.
Beispiel: 17Cl schreiben Lewis-Formel des Cl Atoms. 17Cl=1s22s22p63s23p5
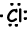
Valenzelektronen von Ionen können auch mit der Lewis-Formel dargestellt werden. Zum Beispiel;
Lewis-Formel von 9F-1 ist; 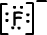
1. Ionenbindung:
Es ist die Bindung zwischen positiv und negativ geladenen Ionen. Metalle und Nichtmetallatome verbinden sich unter Ionenbindung. Metallatome verlieren Elektronen und werden positiv geladen und Nichtmetallatome nehmen Elektronen auf und werden negativ geladen. Die Kraft, die Ionen zusammenhält, ist eine elektrostatische Anziehungskraft.
- Im Periodensystem A verlieren Gruppenmetalle Elektronen in Höhe ihrer Gruppenzahl. Zum Beispiel; Metalle in I A verlieren 1 Elektron und werden +1 Ion, Metalle in II A verlieren 2 Elektronen und werden +2 Ion, Metalle in III A verlieren 3 Elektronen und werden +3 Ion.
- Nichtmetalle akzeptieren Elektronen, die ihre Valenzelektronen zu Edelgasen vervollständigen. Zum Beispiel; Nichtmetalle in der VA-Gruppe nehmen 3 Elektronen auf und werden zu -3 Ionen, Nichtmetalle in der VI-A-Gruppe nehmen 2 Elektronen auf und werden zu -2 Ionen, Nichtmetalle in der VII-A-Gruppe nehmen 1 Elektron auf und werden zu -1 Ionen.
- Während des Ionenbindungsprozesses ist die Anzahl der akzeptierten Elektronen gleich der Anzahl der verlorenen Elektronen.
Beispiel: Analyse der Bindung zwischen NaCl-Molekülen.
11Na verliert 1 Elektron und wird zu Na+. 17Cl nimmt ein Elektron auf und wird zu Cl-. Die Anziehung zwischen entgegengesetzten Ionen bildet eine Ionenbindung.
Die Stärke der Ionenbindung steht in direktem Zusammenhang mit der Tendenz, Elektronen von Metallen zu verlieren und Elektronen von Nichtmetallen aufzunehmen.
2. Kovalente Bindung:
Wenn Atome während des Bindungsprozesses ihre Valenzelektronen teilen, nennen wir das kovalente Bindung. Es findet kein Elektronentransfer statt. Diese Art der Bindung wird zwischen zwei oder mehr Nichtmetallatomen gesehen. Um eine kovalente Bindung zu haben, müssen Atome mindestens ein halb gefülltes Orbital haben. Die kovalente Bindung zwischen H2Molekülen ist nachstehend gezeigt.
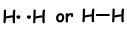
- Die Anzahl der kovalenten Bindungen entspricht der Anzahl der halb gefüllten Orbitale.
- Die erste kovalente Bindung zwischen zwei Atomen wird Sigma-Bindung genannt und mit " σ" angezeigt.
- Es gibt nur eine Sigma-Bindung zwischen zwei Atomen und andere Bindungen werden als Pi-Bindungen bezeichnet und mit " π" angezeigt.
Beispiel: Analyse der Bindung zwischen O2 Molekülen. 8O=1s22s22p4
Oder mit Orbital- und Lewis-Punktschema zeigen;

Wie Sie aus dem Orbitalschema und der Lewis-Punkt-Formel sehen können, hat O zwei halb gefüllte Orbitale und kann zwei Bindungen eingehen. Die erste Bindung heißt Sigma und ist unten dargestellt.
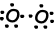
Diese O-Atome teilen sich ihre zweiten Elektronen und werden zu O2 Molekülen;
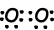
Beispiel: Zeigen Sie kovalente Bindungen von NH3.
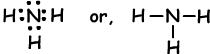
Beispiel: Welche der folgenden Anweisungen ist für das 8O Element falsch?
I. Es ist nichtmetallisch
II. Sie kann zwei Bindungen eingehen
III. In der Elektronenkonfiguration im Grundzustand hat es zwei gefüllte Umlaufbahnen
IV. I. bindet kovalent an das 9F Element.
V. Es bindet sich ionisch an 11Na und bildet eine Verbindung; Na2O
Lösung:
8O hat eine Elektronenkonfiguration im Grundzustand; 
I. Da die Anzahl der Valenzelektronen von 8O 6 beträgt, ist es nichtmetallisch. Wahr
II. Es hat zwei halb gefüllte Umlaufbahnen, kann also zwei Bindungen ausführen. Wahr
III. Wie Sie aus dem Orbitalschema ersehen können, hat 8O 3 gefüllte Orbitalpunkte im Grundzustand. Falsch
IV. 9F hat eine Elektronenkonfiguration im Grundzustand;
F: 1s22s22p5
F hat 7 Valenzelektronen und ist daher nichtmetallisch. Wir haben gelernt, dass sich zwei Nichtmetallatome mit einer kovalenten Bindung verbinden. Wahr
V. 11Na hat Elektronenkonfiguration im Grundzustand;
Na: 1s22s22p63s1
Na gibt ein Elektron und wird zu Na+ und O nimmt 2 Elektronen auf und wird zu O-2. Somit ist die Bindung zwischen ihnen eine Ionenbindung. Wahr.