Polarität chemischer Bindungen
Polarität chemischer Bindungen In Bindungen, die sich zwischen zwei gleichen Atomen bilden, werden Elektronen von gleichen Kräften angezogen. Wir nennen diese Bindungen unpolare kovalente Bindungen . H2, O2 und N2 haben eine unpolare kovalente Bindung. Wenn eine kovalente Bindung zwischen zwei verschiedenen Atomen mit unterschiedlicher Elektronegativität gebildet wird, wird die Kraft, die die Atome auf ein gemeinsames Elektron ausüben, unterschiedlich. Diese Bindungsarten werden polare kovalente Bindungen genannt. HCl, HF, CO sind Beispiele für polare kovalente Bindungen. Moleküle mit polaren Bindungen können polar oder unpolar sein. Um eine Vorstellung davon zu bekommen, ob ein Molekül polar oder unpolar ist, sollten Sie sich die Molekülgeometrie ansehen.
Hybridisierungs und Bindungsgeometrie
Wir haben gelernt, dass Atome Bindungen bilden können, die der Anzahl der halb gefüllten Orbitale entsprechen. Im Gegenteil, wenn wir die Molekülgeometrie oder die unerwartete Anzahl von Bindungen der Gruppen II A, III A und IV A betrachten, erklären wir dies mit einem anderen Konzept, das als Hybridisierung bezeichnet wird. Anhand dieses Konzepts untersuchen wir nun die einzelnen Gruppenelemente und ihre Bindungskapazitäten.
I A Gruppe chemischer Bindungen:
Das Li-Element ist ein Beispiel für eine Gruppe von I A. Lassen Sie mich die Bindung zwischen Li- und H-Atomen untersuchen.
Die Elektronenkonfiguration von Li ist;
Li: 1s22s1
Wie Sie sehen können, hat Li eine halb gefüllte Umlaufbahn und kann eine Bindung bilden. So teilen Li und H ein Elektron und bilden folgende Bindung;
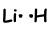
Dieses Molekül ist linear und polar. Wie Sie sich vorstellen können, sind alle Diatomeenmoleküle linear.
II A Gruppe chemischer Bindungen: (sp-Hybridisierung)
Sein Element in dieser Gruppe bildet Bindungen mit H und F; BeH2 und BeF2. Die Elektronenkonfiguration von Be ist;
Be: 1s22s2
Wie aus der Elektronenkonfiguration ersichtlich, hat Be keine halb gefüllten Orbitale. Wir erwarten, dass es keine Bindung bilden kann. Im Gegensatz dazu zeigen Experimente, dass durch Hybridisierung Be Bindungen eingehen.
Während der Bildung der Bindung hat ein Elektron im 2s-Orbital, das auf die 2p-Orbitale und Be übertragen wird, zwei halb gefüllte Orbitale und die Fähigkeit, 2 Bindungen zu bilden. Da sich die Elektronen in verschiedenen Orbitalen befinden (2s und 2p), erwarten wir, dass ihre Eigenschaften unterschiedlich sind. Im Gegenteil, Experimente zeigen, dass diese Bindungen dieselben Eigenschaften haben, sie sind dieselben. Dies wird auch mit der Hybridisierung erklärt.
Diese Orbitale stoßen sich gegenseitig ab und stehen in einem Winkel von 180 ° zueinander und bilden folgende Bindungen; 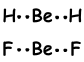
Dieses Molekül ist linear und unpolar. Bindungen sind polar, aber die äquivalente Kraft, die auf Be mit einem Winkel von 180 ° einwirkt, ist null, sodass das Molekül unpolar ist.
III A Gruppe chemischer Bindungen:(sp2 Hybridisierung)
5B-Element in dieser Gruppe bildet Bindungen mit H und F; BeH3 und BeF3. Die Elektronenkonfiguration von B ist;
B: 1s22s22p1
Wie aus der Elektronenkonfiguration hervorgeht, hat B ein halb gefülltes Orbital und kann eine Bindung bilden. Aber wir sehen, dass es 3 Bindungen bildet. Dies ist ein Beispiel für eine sp2-Hybridisierung. Ein Elektron des 2s-Orbitals wird auf das 2p-Orbital übertragen und hat nun 3 halb gefüllte Orbitale und kann 3 Bindungen bilden. Diese drei Bindungen sind wieder dieselben wie im Fall der sp-Hybridisierung und durch Abstoßung befinden sie sich mit einem Winkel von 120 °. Wir zeigen diese Elektronen und binden mit der Lewis-Punkt-Formel.
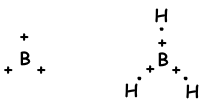
Das Molekül hat eine trigonale planare Geometrie. Dieses Molekül ist auch unpolar, obwohl alle Bindungen polar sind. Da Elektronen mit einem Winkel von 120 ° platziert werden, ist die äquivalente Kraft von ihnen Null, sodass das Molekül unpolar ist.
IV A Gruppe chemischer Bindungen: (sp3-Hybridisierung)
6C-Element in dieser Gruppe bildet Bindungen mit H und F; CH4 und CF4. Die Elektronenkonfiguration von C ist;
C: 1s22s22p2
Wie aus der Elektronenkonfiguration hervorgeht, hat C zwei halb gefüllte Orbitale und kann zwei Bindungen bilden. Aber wir sehen, dass es 4 Bindungen bildet. Dies ist ein Beispiel für eine sp3-Hybridisierung. Ein Elektron des 2s-Orbitals wird auf das 2p-Orbital übertragen und hat jetzt 4 halb gefüllte Orbitale und kann jetzt 4 Bindungen bilden. Diese vier Bindungen sind wieder dieselben wie im Fall der sp- und sp2-Hybridisierung und durch gegenseitiges Abstoßen befinden sie sich mit einem Winkel von 109 °. Wir zeigen diese Elektronen und binden mit der Lewis-Punkt-Formel.
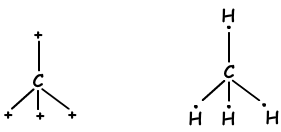
Diese Moleküle haben eine tetraedrische Form und sind unpolare Moleküle.
VA Gruppe chemischer Bindungen:(sp3 -Hybridisierung)
7N-Element in dieser Gruppe bildet Bindungen mit H; NH3. Elektronenkonfiguration von N ist;
N: 1s22s22p3
Wenn wir die Orbitalstruktur dieses Elements betrachten, sagen wir, dass es drei Bindungen bilden kann und keine Hybridisierung erforderlich ist. Im Gegenteil, Experimente mit diesem Element haben gezeigt, dass eine Hybridisierung stattfinden muss, um einen Winkel von 107 ° zwischen den Bindungen zu haben. Somit werden ein 2s und drei 2p-Orbitale gemischt und vier sp3-Hybridorbitale. Eines dieser Orbitale hat 2 Elektronen und verbindet sich nicht, aber es ändert den Winkel im Fall der Tetraeder 109 0 bis 107 0 und bildet eine neue Form “trigonal pyramidal”. Da Ladungen nicht gleichmäßig verteilt sind, ist dieses Molekül polar. Form der NH3-Bindungen;
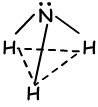
VI A Gruppe chemischer Bindungen:(sp3 -Hybridisierung)
8O-Element in dieser Gruppe bildet Bindungen mit H und F; H2O und OF2. Die Elektronenkonfiguration von O ist;
O: 1s22s22p4
Sauerstoff kann zwei Bindungen bilden, Experimente zeigen jedoch, dass der Winkel zwischen den Bindungen 104,5 ° beträgt. Dies ist nur mit Hybridisierung möglich. Ein s- und 3 p-Orbitale werden gemischt und 4 sp-Hybridorbitale werden gebildet. Diese vier Orbitale enthalten 6 Elektronen und 2 der Orbitale sind zur Hälfte gefüllt und bilden 2 Bindungen. Die Molekülform wird gebogen und das Molekül ist polar.
Beispiel: In welcher der folgenden Verbindungen sind sowohl Molekül als auch Bindungen polar.
(4Be, 5B, 6C, 8O, 16S, 17Cl)
I. BeCl2
II. CO2
III. SCl2
IV. BCl3
V. CCl4
Lösung:
I. Die Lewis-Punktformel von BeCl2 ist nachstehend angegeben; 
Die Molekülform ist linear und unpolar.
II. Die Lewis-Punkt-Formel von CO2 ist unten angegeben; 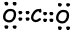
Die Molekülform ist linear und unpolar.
III. Die Lewis-Punkt-Formel von SC12 ist unten angegeben; 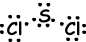
Der resultierende Bindungsvektor ist nicht Null, daher ist das Molekül polar und die Bindungen sind auch polar.
IV. Die Lewis-Punkt-Formel von BCl3 ist nachstehend angegeben; 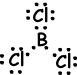
Die Molekülform ist trigonal planar. Da der resultierende Bindungsvektor Null ist, ist das Molekül unpolar.
V. Die Lewis-Punktformel von CCl4 ist nachstehend angegeben; 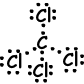
Die Molekülform ist tetraedrisch und das Molekül ist unpolar.
Somit sind sowohl die Bindungen als auch die Struktur des SCl2 Moleküls polar.