Gemische und Partialdruck von Gasen am Beispiel
Gemische und Partialdruck von Gasen am Beispiel
Reagieren Gase nicht miteinander, bilden sie ein homogenes Gemisch. Jedes Gas im Behälter übt Druck aus. Jetzt lernen wir das Konzept in Bezug auf dieses Thema. Partialdruck.
Partialdruck:
Der Partialdruck eines der in einem geschlossenen Behälter befindlichen Gase im Gemisch entspricht dem Druck desselben Gases nur in demselben Behälter bei derselben Temperatur. Das folgende Bild fasst zusammen, was wir zu sagen versuchen. 
Wenn Temperatur und Gasvolumen konstant gehalten werden, ist der Partialdruck des Gases direkt proportional zur Anzahl der Gaspartikel.
Daltons Gesetz des Partialdrucks:
“Die Summe der Partialdrücke der Gase im Behälter ergibt den Gesamtdruck des Gemisches.” Diese Aussage nennt man Daltons Partialdruckgesetz. Bild oben auch Beispiele für dieses Gesetz.
Ptotal =PH2+PCO2
Gase in demselben Behälter haben das gleiche Volumen und teilen den Gesamtdruck entsprechend ihrer Molzahl.
Wenn wir ein ideales Gasgesetz für das gesamte Gas in der Mischung und eines der Gase schreiben und sie untereinander teilen, erhalten wir die Partialdruckgleichung eines Gases in der Mischung.
P1.V = n1.R.T
—– ———–
Ptotal.V=ntotal.R.T
P1=(n1/ntotal).Ptotal
(n1/ntotal) wird Molenbruch von gas1 genannt
P2=(n2/ntotal).Ptotal
P3=(n3/ntotal).Ptotal
…………………………………
Beispiel: In einem geschlossenen Behälter befinden sich 4 Gramm H2. Wenn wir diesem Behälter 4 g He hinzufügen, welche der folgenden Aussagen werden wahr? (H = 1, He = 4)
I. Der Druck von H2 ist gleich dem Anfangsdruck von H2.
II. Die kinetischen Energien der H2- und He-Teilchen sind im Gemisch gleich.
III. Der Partialdruck von H2 im Gemisch ist doppelt so hoch wie der von He.
Lösung:
I. Wir finden den Partialdruck von H2 unter Anwendung des idealen Gasgesetzes.
PH2.V=nH2.R.T
PH2=nH2.R.T/V
Da V, T und nH2 konstant sind, ändert sich der Partialdruck von H2 nicht. Ich bin wahr
II. Da die Temperatur des homogenen Gemisches im Behälter gleich ist, ändern sich die kinetischen Energien der Partikel nicht und die kinetische Energie der H2-Partikel ist gleich der kinetischen Energie der He-Partikel. II ist wahr.
III. Molmasse von H2 = 2,1 = 2
Mol H2; nH2=4/2=2mol
Mole of He;
nHe=4/4=1mol
Partialdruck ist direkt proportional zur Anzahl der Mol; Der Partialdruck von H2 ist also doppelt so hoch wie der Partialdruck von He. III ist wahr.
Beispiel: Behälter enthält 0,4 Mol CH4, 0,1 Mol SO2 und 0,3 Mol He. Wenn der Partialdruck von He 60 cm Hg beträgt, welche der folgenden Aussagen ist falsch? (C = 12, H = 1, S = 32, O = 16)
I. Die Mischung enthält 50 Mol-% CH4.
II. Der Gesamtdruck des Behälters beträgt 160 cm Hg
III. Die Dichte von SO2 beträgt das Vierfache der Dichte von CH4
IV. Der Partialdruck von SO2 beträgt 20 cm Hg.
Lösung:
I. Gesamtmol Gase; ntotal=0,4+0,1+0,3=0,8mol
nCH4=(0,4/0,8).100=50
I ist wahr.
II. Partial pressure of He is 60 cm Hg
PHe=(nHe/ntotal).Ptotal
60=(0,3/0,8).Ptotal
Ptotal=160 cm Hg
II ist wahr.
III. Molmassen von SO2 = 32 + 2,16 = 64 und CH4=12+4.1=16
Massen von mSO2=nSO2.MmSO2=0,1.64=6,4 g und mCH4=nCH4.MmCH4=0,4.16=6,4 g
Da sie gleiche Volumina und Massen haben, ist d = m / V
ihre Dichten sind auch gleich, III ist falsch.
IV. Partialdruck von SO2 PSO2=(nSO2/ntotal).Ptotal
PSO2=(0,1/0,8).160
PSO2=20 cm Hg IV. ist wahr.
Gasdruck in kombinierten Behältern
Das Bild unten zeigt zwei Behälter in Kombination mit Hahn A. 
X- und Y-Gase werden in Behälter I und II gefüllt, sie reagieren nicht miteinander. Wenn wir den Hahn zwischen Behältern öffnen, welche Mengen des Gesamtsystems ändern sich? Wir versuchen diese Frage jetzt zu beantworten.
Wir haben gelernt, dass Gase vom Hochdruck zum Niederdruck diffundieren. In diesem System diffundieren Gase mit höherem Druck in andere Behälter, bis der Druck ausgeglichen ist. Da keine Reaktion stattfindet, sind Anfangs- und Endanzahl der Mole von X- und Y-Gasen gleich. Die Gesamtzahl der Mole entspricht der Summe von n1 und n2.
Gleichung I. ntotal=n1+n2
Wenn wir für jede Situation ein ideales Gasgesetz schreiben;
n1=(P1.V1)/(R.T), n2=(P2.V2/R.T), ntotal=(Pfinal.Vfinal/.RT)
wir setzen diese Gleichungen in Gleichung I ein und erhalten;
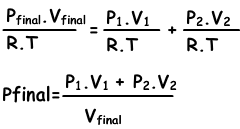
Wir können V1+V2 auch in Vfinal schreiben.
Beispiel: Wenn wir den Hahn öffnen und eine Systembilanz erstellen, welche der folgenden Aussagen werden für dieses System wahr? 
I. Der Enddruck von Y ist größer als der Anfangsdruck von Y
II. Partialdrücke von X und Y werden gleich.
III. Der Gesamtdruck wird 2,4 atm
Lösung:
I. Das Anfangsvolumen des Gases Y beträgt 6 V, das Endvolumen von Y 10 V. Da die Temperatur und die Anzahl der Mole konstant sind, das Volumen von Y jedoch zunimmt, nimmt der Druck ab. Ich bin falsch
II. Partialdrücke von Gasen sind direkt proportional zu ihrer Molzahl. Wir ermitteln die Anzahl der Mol Gase und geben dann die Beziehung zwischen ihren Partialdrücken unter Verwendung des idealen Gasgesetzes an.
n=P.V/R.T
nX=Px.Vx/R.T=3.4V/RT=12V/RT
nY=PY.VY/R.T=2.6V/RT=12V/RT
Da die Anzahl der Mol Gase gleich ist, werden auch deren Partialdrücke gleich.
III. Pfinal=(Px.Vx+Py.Vy)/(Vx+Vy)
Pfinal=(3.4V+2.6V)/(4V+6V)
Pfinal=24V/10V=2,4 atm
III ist wahr.