Ideales Gasgesetz
Ideales Gasgesetz
Im ideales Gas; Moleküle haben kein Volumen und es gibt keine Wechselwirkung zwischen ihnen. In der Realität gibt es kein solches Gas, es ist nur eine Annahme. Alle realen Gase haben kleine Volumina und es gibt Wechselwirkungen zwischen ihnen. Bei Problemlösungen; Wir nehmen alle Gase als ideales Gas an. Die unten angegebene Gleichung ist das ideale Gasgesetz. Wir erhalten es, indem wir alle im letzten Abschnitt angegebenen Gasgesetze kombinieren.
P.V = n.R.T.
Wo; P Druck, V Volumen, n Partikelanzahl, R Gaskonstante 0,08206 L atm / K mol oder 22,4 / 273 L atm / K mol und T Temperatur
Zum besseren Verständnis lösen wir nun einige Probleme im Zusammenhang mit dem idealen Gasgesetz. Befolgen Sie jedes Beispiel sorgfältig.
Beispiel: In einem Behälter mit einem Volumen von 1230 cm3 bei 27 ° C einen Druck von 8,8 g CO2 ermitteln. (C = 12, O = 16)
Lösung: Wir finden zuerst die Molmasse von CO2; CO2=12+2.16=44
Dann finden wir Mol CO2;
n=8,8/44=0,2 Mol
Umwandlung der Temperatur von 0 ° C in K und des Volumens von cm3 in Liter;
T=27+273=300 K
V=1230 cm3=1,23 Liters
Nun verwenden wir das ideale Gasgesetz, um unbekannte Größen zu finden.
P.V=n.R.T
P.1,23=0,2.0,08206.300
P=4 atm
Beispiel: Finden Sie die Molmasse von X (Gas) mit einem Volumen von 896 cm3, einer Temperatur von 273 ° C und einer Masse von 0,96 g. (O = 16 und atmosphärischer Druck ist 1 atm)

Lösung:
Wir führen zuerst Einheitenumrechnungen durch. P=38 cm Hg=38/76=0,5 atm
V=896/1000=0,896 liter
T=273 + 273=546 K
Nun verwenden wir das ideale Gasgesetz, um n zu finden; P.V=n.R.T
0,5.0,896=n.(22,4/273).546
n=0,03 Mol
Molmasse von X;
MX=mX/n=0,96/0,03
MX=32 g/mol
Somit; X(gas)=O2
Beispiel: Das unten angegebene System wird an einem Ort mit 70 cm Hg atmosphärischem Druck aufgestellt. Behälter hat zuerst 2 g He, dann geben wir 1 g H2-Gas in diesen Behälter. Finden Sie den Anstieg von Hg im Manometer, nachdem Sie H2 hinzugefügt haben.(He=4, H2=2)

Pinitiale=P0-20=70-20=50 cm Hg
ninitiale=2/4=0,5mol He
nH2=1/2=0,5mol H2
nfinal=nHe+nH2
nfinale=0,5+0,5=1mol
Wir schreiben ein ideales Gasgesetz für Anfangs- und Endwerte und tauchen sie dann aufeinander, um einen unbekannten Wert zu finden.
V und T sind in zwei Situationen konstant. 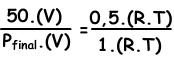
Pfinale=100 cm Hg
Unterschied zwischen Hg-Werten zwischen zwei Manometerzweigen;
100-70 = 30 cm im rechten Zweig des Manometers
Somit wird der Unterschied zwischen dem Anfangsniveau und dem Endniveau von Hg;
20 + 30 = 50 cm
Diese Änderung wird von zwei Zweigen des Manometers geteilt;
50/2 = 25 cm
Somit steigt Hg in einem Manometerzweig um 25 cm an.