Phasen (Zustände) der Materie mit Beispielen
Phasen (Zustände) der Materie mit Beispielen
Angelegenheiten können in vier staaten existieren; fest, flüssig, gasförmig und plasmaförmig. Einige spezifische eigenschaften dieser phasen sind in der folgenden tabelle angegeben. 
In dieser einheit untersuchen wir feststoffe, flüssigkeiten und gase. Die unten angegebene form fasst die phasenänderungen von festen zu flüssigen, flüssigen zu gasförmigen substanzen zusammen.
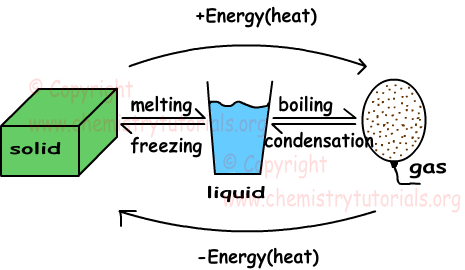
Durch die wärmegewinnung in drei phasen der materie wird die durchschnittliche kinetische energie der partikel erhöht. Bei gleicher materie ist die kinetische energie der partikel in der gasphase größer als die kinetische Energie in festem und flüssigem zustand. Im folgenden werden einige konzepte im zusammenhang mit phasenänderungen definiert.
Schmelzen: Feststoffe ändern ihren zustand in flüssig.
Einfrieren: Der entgegengesetzte prozess des schmelzens wird als einfrieren bezeichnet. Flüssige materie verliert wärme und verwandelt sich in feste materie.
Kochen: Flüssige stoffe gewinnen wärme und verwandeln sich in gas.
Kondensation: Der entgegengesetzte siedevorgang wird als kondensation bezeichnet. Gas moleküle verlieren wärme und verwandeln ihre phase in flüssigkeit.
Während des phasenwechsels bleibt die temperatur der materie konstant. Diagramme der phasenänderung sind unten angegeben.
Das Temperatur-Zeit-diagramm der erhitzten reinen festen substanz ist nachstehend angegeben. 
In intervallen I. III. und V. temperatur der materie steigt. Da materie rein ist, nimmt auch ihre kinetische energie zu. Wir können die in diesen intervallen gewonnene wärme mit der folgenden formel ermitteln:
Q=m.c.ΔT
wo; m ist Masse, c ist spezifische wärmekapazität und ΔT ist Temperatur änderung (Tfinale-Tinitiale)
In intervallen II. und IV. die temperatur der materie bleibt konstant, da sich die phase der materie ändert. Da die temperatur der materie konstant ist, ist auch deren kinetische energie konstant. Im gegenteil, während des phasenwechsels nehmen die abstände zwischen den molekülen zu, wodurch auch die potentielle energie der materie zunimmt. In diesen intervallen liegen heterogene gemische vor, beispielsweise in Intervall II. wir haben feste + flüssige mischung und in intervall IV. wir haben flüssigkeit + gas-gemisch. In diesen intervallen wird die benötigte wärme mit den folgenden formeln ermittelt: Q=m.LVerschmelzung or Q=m.LVerdampfung
wo m Masse ist, ist LVerschmelzung latente schmelzwärme und LVerdampfung latente verdampfungswärme.
Die verlustwärme der materie in der gasphase hat den nachstehend angegebenen Temperatur-Zeit-Verlauf. 
Wie sie in beiden diagrammen sehen können, wird der siedepunkt zum kondensationspunkt und der schmelzpunkt wird beim abkühlen zum gefrierpunkt. Ihre größen sind gleich. Wir verwenden die oben angegebenen formeln, um die Wärme zu ermitteln, die von der materie während dieses prozesses freigesetzt wird.
Wir lösen einige beispiele im zusammenhang mit phasenwechsel.
Beispiel: Ermitteln sie die erforderliche wärme, um die temperatur von 100 g eis von 00C auf 40 0C zu erhöhen. (cwasser=1cal/g0C, LVerschmelzung=80cal/g)
Lösung: Wir schmelzen zuerst Eis und erhitzen es dann auf 40 0C. Q1 = m. L Verschmelzung Q1=100g.80.cal/g
Q1=8000 cal
Jetzt erhöhen wir die Temperatur von 0 auf 400C
Q2=m.c.ΔT
Q2=100.1.(40-0)
Q2=4000cal
Qgesamt=Q1+Q2=8000cal+4000cal=12000cal.
Beispiel: Wenn wir zwei wässer mit einer masse von 150 g, einer temperatur von 400C und 100 g und einer temperatur von 800C mischen, ermitteln sie die endtemperatur der gemische (cwasser= 1cal / g.0 ° C).
Lösung:
Wenn sich zwei gegenstände mit unterschiedlichen temperaturen berühren, besteht ein wärmeübergang zwischen ihnen. Wärme fließt von materie mit höherer temperatur zu materie mit niedriger temperatur, bis sie gleiche temperaturen haben. Die gewonnene wärme entspricht immer dem wärmeverlust. 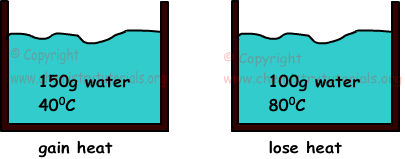
Die temperatur der endgültigen mischung muss zwischen den temperaturen beider wässer liegen. 400C<Tfinale<800C
Qgewonnen=Qverloren
m1.c1.ΔT1=m2.c2.ΔT2
150.1.(T-40)=100.1.(80-T)
T=560C
Materie und Eigenschaften von Materie Prüfungen und Problemlösungen