Equilibrio químico
Equilibrio químico
Hasta ahora, hemos aprendido que las reacciones tienen lugar en una dirección. Pero ahora nos ocupamos de las reacciones reversibles. La reacción, a continuación, es en recipiente cerrado;
A(g) + B(g) → C(g) + D(g)
Al principio, A reacciona con B y C y producir gas D. Esto es adelante reacción y la velocidad de esta reacción se escribe como;
Velocidad de reacción = kf.[A].[B]
Dado que las concentraciones de disminución A y B con el tiempo, la velocidad de reacción hacia adelante también disminuye. Además, producido C y D moléculas chocan entre sí y formar moléculas A y B. Esto se denomina reacción inversa y la tasa de que se escribe como;
Velocidad de reacción = kr. [C]. [D]
Las concentraciones de C y D gases aumentos y A y B disminuye con el tiempo. En uno velocidades de reacción de punto de la reacción de avance y retroceso se hace igual y la reacción alcanza el equilibrio. Escribimos estas ecuaciones como;
kf.[A].[B] = kr.[C].[D]
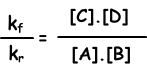
kf/kr= constante de equilibrio y representado con Kc en términos de concentración. Constante de equilibrio de la reacción siguiente se escribe como;
aA + bB ↔ cC + dD
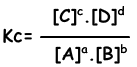
Ecuación de equilibrio se escribe de reacción total. No se refieren a los pasos de reacciones como en el caso de una reacción de dirección. Las reacciones deben obedecer las reglas siguientes para alcanzar el equilibrio;
El sistema debe ser cerrado
La temperatura debe ser constante
La reacción debe ser reversible
Si los cambios de temperatura, a continuación, las velocidades de reacción de avance o de retroceso puede ser cambiado y el sistema no alcanzar el equilibrio. Si la reacción no es reversible, no se puede hablar de equilibrio. Finalmente, los sistemas cerrados requerido para evitar la pérdida de materia durante la reacción. Ahora nos enteramos de por qué los sistemas tienden a alcanzar el equilibrio.
Todos los sistemas desea disminuir su energía. Es la tendencia de un mínimo de energía.
Todos los sistemas tienden a aumentar su desorden. Se llama como tendencia de máximo desorden.
El agua en un recipiente abierto se evapora con el tiempo. El agua líquida tiene una energía más baja que el agua de gas y obedecer la ley de un mínimo de energía. Por el contrario, la vaporización de la misma puede ser explicada por la ley máximo desorden. Moléculas de agua líquida cambia su fase de gas y aumentar su desorden.
Trastorno de la;
Gas> Soluciones> líquido> Sólidos
Energía de;
Gas> líquido> Sólidos
P.S:
La disolución de los sólidos y líquidos son exotérmicas o endotérmicas. Sin embargo, la disolución de los gases son siempre exotérmica.
Ejemplo: ¿Cuáles de las siguientes reacciones puede ser exotérmica?
I. 2HI(g) ↔ H2(g) + I2(g)
II. 2NH3(g) ↔ N2(g) + 3H2(g)
III. CO2(g) ↔ CO2(aq)
IV. CaCO3(s) ↔ CaO(s) + CO2(g)
V. N2O4(g) ↔ 2NO2(g)
Solución: I, II, V y reacciones están todos en fase gaseosa. Trastorno aumenta en dirección productos. Así, estas reacciones son endotérmicas. En la reacción IV, el cambio de fase sólida materia y se convierte en gas. Dado que aumenta el desorden de sólido a la fase de gas, esta reacción es endotérmica. En reacción III, trastorno aumenta a partir de productos reaccionantes y la reacción es exotérmica.
Equilibrio homogénea y heterogénea
Si en materia reacción de equilibrio están todos en una fase de equilibrio, entonces es homogénea, si al menos uno de la materia tiene fase diferente, entonces es equilibrio heterogéneo.
Cuando escribimos la ecuación de equilibrio de equilibrio heterogéneo, que no escribo puras materias sólidas y líquidas en pura ecuación de equilibrio. Por ejemplo;
2NH3(g) ↔ N2(g) + 3H2(g)
la reacción es la reacción homogénea y escribimos todos los asuntos que a la ecuación de equilibrio.
CaCO3(s) ↔ CaO(s) + CO2(g)
Esta reacción es la reacción de equilibrio heterogéneo y no escribir CaCO3 (s) y CaO (s) en la ecuación de equilibrio.
Constante de equilibrio en términos de la presión parcial
Las concentraciones de los gases son directamente proporcionales a la presión parcial de ellos. Así, podemos escribir la constante de equilibrio en términos de presiones parciales.
N2(g) + 3H2(g) ↔ 2NH3(g)
Constante de equilibrio de esta reacción en términos de concentraciones es;
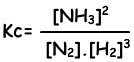
Constante de equilibrio de esta reacción en términos de presión parcial es;
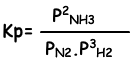
Relación entre estos dos es constante de equilibrio;
Kp=Kc(R.T)∆n
∆n = Σnreactivos - Σnproductos
Por ejemplo:
N2(g) + 3H2(g) ↔ 2NH3(g)
Desde Δnproducts = 2 (2 mol NH3) y Δnreactants =4 (1 mol N2 y 3 mol H2)
∆n = -2
Kp=Kc.(R.T)-2