Equilibrio químico Cheat Sheet
Equilibrio químico Cheat Sheet
Hasta ahora, hemos aprendido que las reacciones tienen lugar en una dirección. Pero ahora nos ocupamos de las reacciones reversibles. La reacción, a continuación, es en recipiente cerrado;
A (g) + B (g) → C (g) + D (g)
Al principio, A reacciona con B y C y producir gas D. Esto es adelante reacción y la velocidad de esta reacción se escribe como;
Velocidad de reacción = kf. [A]. [B]
Dado que las concentraciones de disminución A y B con el tiempo, la velocidad de reacción hacia adelante también disminuye. Además, producido C y D moléculas chocan entre sí y formar moléculas A y B. Esto se denomina reacción inversa y la tasa de que se escribe como;
Velocidad de reacción = kr. [C]. [D]
Constante de equilibrio de la reacción siguiente se escribe como;
aA + bB ↔ cC + dD
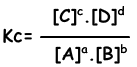
Equilibrio homogénea y heterogénea
Si en materia reacción de equilibrio están todos en una fase de equilibrio, entonces es homogénea, si al menos uno de la materia tiene fase diferente, entonces es equilibrio heterogéneo. Cuando escribimos la ecuación de equilibrio de equilibrio heterogéneo, que no escribo puras materias sólidas y líquidas en pura ecuación de equilibrio.
CaCO3(s) ↔ CaO(s) + CO2(g)
Esta reacción es la reacción de equilibrio heterogéneo y no escribir CaCO3(s) y CaO (s) en la ecuación de equilibrio.
Constante de equilibrio en términos de la presión parcial
Las concentraciones de los gases son directamente proporcionales a la presión parcial de ellos. Así, podemos escribir la constante de equilibrio en términos de presiones parciales.
N2(g) + 3H2(g) ↔ 2NH3(g)
Constante de equilibrio de esta reacción en términos de concentraciones es;
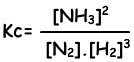
Constante de equilibrio de esta reacción en términos de presión parcial es;
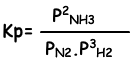
Factores que afectan el equilibrio químico
1. Efecto de la concentración en equilibrio:
Adición o eliminación de las cosas en equilibrio de la reacción efecto. Por ejemplo, los productos de adición de reactivos o la eliminación de aumentar el rendimiento del producto. Por el contrario, la adición de productos o la eliminación de sustancias reaccionantes aumentar el rendimiento de los reactivos. Yo otras palabras, en equilibrio primera situación se desplaza hacia la derecha y en equilibrio segunda situación se desplaza hacia la izquierda.
2. Efecto de la temperatura en equilibrio:
En una reacción endotérmica, aumentando el equilibrio térmico del giro a la derecha y el equilibrio de los aumentos constantes.
En una reacción endotérmica; aumentar el equilibrio térmico del giro a la izquierda y el equilibrio disminuciones constantes.
3. Efecto de la presión sobre el equilibrio:
Si uno de los asuntos en un recipiente a temperatura y presión constantes se quita o se añade, la presión de los cambios en el sistema. Sin embargo, el cambio en la concentración se toma en consideración no presión.
La temperatura puede ser cambiado bajo volumen constante. En esta situación, incluso si los cambios de presión, tenemos en cuenta los cambios en la temperatura, mientras que la búsqueda constante de equilibrio.
En las reacciones de gas, si no hay cambio en el número de moles, entonces la presión no tienen efecto sobre el equilibrio.