Configuración electrónica con ejemplos
Configuración electrónica con ejemplos
Los electrones no se colocan en posiciones fijas en los átomos, pero podemos predecir las posiciones aproximadas. Estas posiciones son llamados niveles de energía o las cáscaras de los átomos.
Más bajo nivel de energía es una y se denota con el entero n = 1, 2, 3, 4, 5, 6 … o las letras a partir de K, L, N de P. Un átomo puede tener un máximo de 7 niveles de energía y los electrones pueden cambiar sus niveles de acuerdo a sus energías.
Cada nivel de energía tiene un número distinto de electrones. Por ejemplo, podemos encontrar el número de electrones en el nivel de energía de cuatro con la siguiente fórmula; 2n2.
1 º nivel de energía tiene;
2n2 = 2,12 = 2 electrones
Segundo nivel de energía tiene;
2n2 = 2.22 = 8 electrones
3 º nivel de energía tiene;
2n2 = 2.32 = 18 electrones
Los electrones se encuentran los niveles de energía a partir de los niveles de energía en primer lugar. Si uno de los niveles de energía está lleno, entonces los electrones se colocan siguiendo el nivel de energía.
Siguientes imágenes muestran la ubicación de los electrones de los átomos de O y Mg.
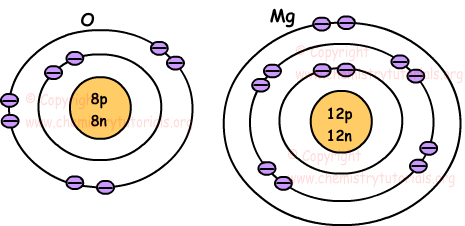
Número de electrones en la capa externa del átomo nos da la siguiente clasificación.

Configuración electrónica del átomo de muestra, conchas, sub y el número de electrones en capas sub. Examinamos configuración electrónica con los siguientes ejemplos.
Ejemplo: Helio dos
1s2
donde;
1 es el número cuántico principal o el nivel de energía (shell)
s es la capa sub-nivel o sub (capacidad de s sub cáscara es de 2 electrones)
2 muestra el número de electrones en la capa sub s
Ejemplo: Cloro 17
1s22s22p63s23p5
Coeficientes 1, 2, 2, 3, y 3 niveles de energía de Cl. Como se puede ver “p” sub shell puede tener un máximo de 6 electrones.
Superíndices 2, 2, 6, 2 y 5 electrones de las capas sub “s” y “p”.
Ejemplo: Bromo 35
1s22s22p63s23p64s23d104p5
Como se puede ver “d” sub shell puede tener un máximo de 10 electrones.
Ejemplo: Tantalio 73
1s22s22p63s23p64s23d104p65s24d105p66s24f145d3
Como se puede ver “f” sub shell puede tener un máximo de 14 electrones.