Gases de Exámen 4 y soluciones a los problemas
Gases de Exámen 4 y soluciones a los problemas
1. Encontrar la densidad de C4H8 en 273 0C de temperatura y 2 atm de presión. (H = 1, C = 12)
Solución:
T = 273 + 273 = 546 0K
P = masa 2atm y molar de C4H8 = 4. (12) + 8 (1) = 56g/mol
Nosotros usamos la ley del gas ideal para encontrar la densidad del gas;
P.MC4H8= d.R.T
2,56 = D.0, 082,546
d = 2,5 g / l
2. Si la suma de las presiones de 1,6 y 0,8 g Él CH4 gases g es de 0,9 atm, encontrar las presiones parciales de Él y CH4. (He = 4, C = 12, H = 1)
Solución:
Moles de gases;
nHe = 1,6 / 4 = 0,4 mol
nCH4 = 0,8 / 16 = 0,05 mol
ntotal = 0,4 + 0,05 = 0,45 moles
Presiones parciales de los gases se encuentran por la fórmula;. Px = (nx /ntotal) Pntotal
Pp = 0,4 / 0,45,0,0 = 0,8 atm
PCH4 = 0,05 / 0,45.0,4 = 0,1 atm
3. Allí son el gas en un contenedor determinado. ¿Cuál de las siguientes afirmaciones son verdaderas para este recipiente a temperatura constante?

I. Si se añade CH4 de gas en el recipiente, la presión parcial de él aumenta.
II. Si a esto añadimos O2 (g) en un recipiente, la densidad de los gases en los aumentos de los contenedores.
III. Si añadimos el gas Ar en el recipiente, la energía cinética media se mantiene constante.
Solución:
I. Adición de CH4 en un recipiente aumenta el número total de moles, pero en moles de Él no cambia, por lo que su presión parcial se mantiene constante. Que es falso.
II. Si a esto añadimos O2 (g) en un recipiente, la masa total de los aumentos de gases, y puesto que el volumen es constante, la densidad de los gases aumenta. II es verdadera.
III. Todos los gases tienen el mismo promedio de la energía cinética en la misma temperatura. III es verdadera.
4. ¿Cuáles de las siguientes afirmaciones son verdaderas para el CH4 y le da en la imagen siguiente;

I. Las presiones de CH4 y él son iguales.
II. Número de colisiones a la unidad de superficie por unidad de tiempo son iguales entre sí.
III. Sus densidades son iguales.
Solución:
I. Desde el CH4 y tiene un volumen igual de temperatura, y el topo sus presiones también son iguales. I es verdadera.
II. Número de Identificación del colisiones en la unidad de tiempo directamente proporcional a la velocidad de los gases.
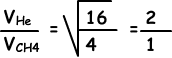
La velocidad de Él es mayor que la velocidad de CH4, por lo que el número de colisiones de Él es más grande que el número de colisiones de CH4.II es falso.
III. Dado que las masas molares de CH4 y Él son diferentes, sus densidades son también diferentes. III es falsa.
5. Hay algo de gas ideal en un recipiente cerrado que tiene un volumen constante. ¿Cuáles de los gráficos que figuran a continuación son válidos para este gas? (P: presión, T: temperatura, d: Densidad)

Solución:
I. Dado que el número de moles y el volumen de gas son constantes, el aumento de temperatura aumenta la presión. I es verdadera.
II. PV es directamente proporcional a la temperatura y el número de moles. Desde mol de gas es el constante aumento y T, PV también se incrementa. II es verdadera.
III. Dado que el número de moles, el volumen y la masa de gas son constantes, la densidad se mantiene constante. III es verdadera.