Gases de Exámen 3 y soluciones a los problemas
Gases de Exámen 3 y soluciones a los problemas
1. Encontrar el volumen de 0,5 mol de CH4 en 3,28 atm de presión y temperatura de 400 0K.
Solución:
P = 3,28 atm, n = 0,5 mol, T = 0 K 400, R = 0.082, V =?
Usamos la ley de los gases ideales;
P.V = n.R.T
3,28. V = 0,5.0,082.400
V = 5 litros
2. Si 6,4 g de CH4 tiene la presión de 0,5 atm y el volumen de 2 litros, encontrar la presión de 9 g C2H6 tener un litro de volumen a temperatura constante. (C = 12, H = 1)
Solución:
En primer lugar, encontrar un mol de que ciertos asuntos;
nCH4 = 6,4 / 16 = 0,4 mol
nC2H6 = 9.30 = 0,3 mol
Puesto que la temperatura es constante podemos escribir la ley del gas ideal como se indica a continuación;
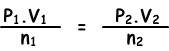
(0,5.2)/0,4=(P2.1)/0,3
P2=0,75 atm
o, P2= 57 cm Hg
3. Encontrar la densidad de O2 menores de 27 0C años la temperatura 0 º C y 1,23 atm de presión. (S = 16)
Solución:
T = 27 + 273 = 300 0K
Si escribimos la ley del gas ideal para la densidad, se obtiene la siguiente ecuación;
d = (p.m) / (R.T)
donde M es la masa molar de O2.
d = (1,23.32) / (0,082.300)
d = 1,6 g / litro
4. Si abrimos los grifos que figuran en el cuadro a continuación, encontrar la temperatura final de los gases.

Solución:
Usamos siguiente ecuación para encontrar la presión final de mezcla de gases;
P1.V1 + P2.V2 + P3.V3 = Pfinal.Vfinal
3.2 + 4.3 + 0.5 =Pfinal.(2+3+5)
6 + 12=Pfinall.10
Pfinal=1,8 atm
5. Cuando abrimos los grifos que figuran en el cuadro a continuación, encontrar cambios en las presiones de los gases.

Solución:
Debemos encontrar la presión final del sistema para hacer la comparación.
P1.V1 + P2.V2 + P3.V3 = Pfinal.Vfinal
P.V + 2P.2V + 3P.V = Pfinal.(V+2V+V)
Pfinal = 2P
Por lo tanto,
I. La presión de aumento primer contenedor
II. La presión de segundo recipiente se mantiene constante
III. La presión del recipiente tercera disminuye