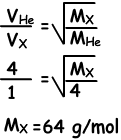Efusión y difusión de los gases con ejemplos
Difusión:
Las moléculas de la mezcla de un gas con moléculas de otro gas se llama difusión. El olor de un perfume o una comida en una habitación son algunos ejemplos comunes de difusión de los gases. Los gases tienen diferentes tasas de difusión a diferentes temperaturas. Fórmula siguiente muestra relación de las tasas de difusión de dos gases a la misma temperatura.
Tasa de difusión (r) es directamente proporcional a la velocidad molecular media.
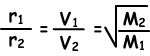
Donde, r1 y r2 son las tasas de difusión de gas 1 y 2 de gas, V1 y V2 son velocidades promedio molecular de los gases y M1 y M2 son las masas moleculares de los gases.
Ecuación dada arriba es también llamada “Ley de Difusión de Graham”.
Ahora, vamos a dar relación de difusión de dos gases diferentes a diferentes temperaturas. Vamos a T1 y T2 son las temperaturas absolutas de gases.
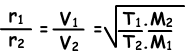
En resumen;
La velocidad de difusión de gas;
es inversamente proporcional a la raíz cuadrada de la masa molar
es directamente proporcional a la raíz cuadrada de la temperatura absoluta
Por lo tanto;
Si los gases tienen la misma temperatura, uno de ellos con menor masa molar tiene una mayor tasa de difusión. Si los gases tienen masa molar igual, uno de ellos con una temperatura más alta tiene una mayor tasa de difusión.
Efusión:

Como se puede ver en la imagen dada anteriormente, el movimiento de los gases de un recipiente a otro pasando a través de pequeño orificio se conoce como derrame (como aparece en la imagen, en el segundo contenedor general, está vacío, o vacío). Difusión se lleva a cabo bajo constante la presión sobre el derrame sucede lo contrario en la diferencia de presión entre los contenedores. Las tasas de efusión de los gases de los cambios de acuerdo a la ley de difusión de Graham. Ahora podemos resolver algunos ejemplos relacionados con la difusión y efusión de gases.
Ejemplo: Si los gases SO2 y X se envían al mismo tiempo de los puntos A y B, se encuentran en el punto de 20 cm de B. ¿Cuál de las siguientes afirmaciones son verdaderas? (SO2 = 64)
I. masa molar de X es de 4
II. Si aumentamos la temperatura absoluta de SO2 y mantener la temperatura constante de X, punto de encuentro de los gases de acercarse a A.
III. Si reducimos la temperatura absoluta de los gases a la misma cantidad, punto de encuentro no cambia.

solución:
I. Desde el punto de encuentro de los gases es de 20 cm de distancia de B, las moléculas de X se mueven 4 veces más rápido que las moléculas de SO2.
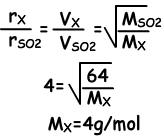
I es verdad
II. SO2 se mueve más lento que el X, si aumentamos la temperatura de SO2, aumenta su velocidad y punto de encuentro más cerca del punto A. II también es cierto.
III. La disminución de la temperatura de los gases a la misma cantidad, no afecta el punto de encuentro. III es cierto
Ejemplo: ¿Cuál de las siguientes afirmaciones son verdaderas para la velocidad molecular media de las moléculas de H2 y N2. (H = 1, N = 14)
I. moléculas de N2 a 40 0C son más lentas que las moléculas de H2 a 40 0C.
II. Las moléculas de H2 a 80 0C son más lentas que las moléculas de N2 a 40 0C.
III. Las moléculas de N2 a 80 0C es más rápido que las moléculas de H2 a 40 0C.
solución:
Masa molar del H2 = 2 g / mol, masa molar del N2 = 28 g / mol.
I. Dado que la masa molar de N2 es mayor que H2, las moléculas de N2 se mueven más lentamente que H2. I es verdad
II. La velocidad molecular media es directamente proporcional a la raíz cuadrada de la temperatura absoluta. Así, las moléculas de H2 son más rápidas que las moléculas de N2. II es cierto
III. Las moléculas de N2 a 80 0C es más rápido que las moléculas de H2 a 40 0C. III es cierto.
Ejemplo: Bajo una temperatura constante, cuando abrimos los grifos de los gases se encuentran en el punto A. Encontrar la masa molecular de X (gas).

solución:
Ya que se encuentran en el punto A, las moléculas de He son más rápidos que las moléculas de X. En vez He toma distancia de 4 unidades, X tiene una unidad de distancia.