La densidad de los gases con ejemplos
La densidad de los gases con ejemplos
Densidad de los gases es muy pequeña con respecto a las fases sólida y gaseosa. Podemos encontrar la densidad con la siguiente fórmula;
d (gas) = m (gas) / V (gas)
si lo sustituimos en la ley del gas ideal;
P.V = n.R.T donde n = masa / masa molar
P.V=(m/Mm).R.T
P.Mm=(m/V).R.T
P.Mm=d.R.T
d=(P.Mm)/(R.T)
Como se puede ver en la fórmula, la densidad de los gases es directamente proporcional a la presión y la masa molar, e inversamente proporcional a la temperatura.
Ejemplo: Encontrar la densidad de C4H8 a 273 0C y bajo la presión de 2 atm. (H = 1, C = 12)
Solución: hacemos convenios primera unidad;
T=273+273=546 K
P=2 atm
C4H8=4.12+8.1=56 g/mol
Utilizando la fórmula dada anteriormente;
P.Mm=d.R.T
2.56=d.(22,4/273).546
d=2,5 g/L
Ejemplo: Si añadimos unos CH4 a un contenedor a continuación a temperatura constante, cuáles de las siguientes afirmaciones son verdaderas en relación con los gases en este recipiente? (He = 4, C = 12, H = 1)

I. La densidad de la mezcla aumenta
II. aumenta el volumen de
III. aumenta la presión
solución:
Masa molar del CH4 ==12+4.1=16
Desde el pistón del contenedor es dinámico, cuando añadimos CH4, el volumen de los aumentos de mezcla. Masa molar del CH4 es mayor que él, por lo tanto la densidad de la mezcla también se incrementa.
P. Mm = d.R.T
El aumento en el volumen de la presión del gas balance y se mantiene constante.
Ejemplo: ¿Cuáles de los gráficos son ciertas para el gas ideal.

solución:
I. Utilizar la ley de los gases ideales;
P.V = n.R.T
P = n.R.T / V
Desde R, N y V son constantes, P es directamente proporcional a la temperatura. Gráfico I es cierto.
II. Volumen molar es V / n. Usando la ley de los gases ideales;
V / n = R.T / P
Desde R, P y T son constantes V / n debe ser constante. Así el segundo gráfico es falsa, la relación entre la línea que muestra V y n debe ser paralelo a n.
III. Escribimos ley del gas ideal de densidad;
d = P.Mm / R.T
Mm, R y P son constantes, por lo tanto d es inversamente proporcional a T. III. gráfico es cierto.
Ejemplo: el gráfico a continuación muestra la densidad vs relación volumen de X (gas) a 00C. Si la presión de X (gas) en el punto A es de 1 atm, ¿cuáles de las siguientes declaraciones son verdaderas para este gas.

I. n = 1mol
II. Presión en el punto B es de 0,5 atm
III. Masa molar del gas es de 56 g
solución:
I. ley del gas ideal en el punto A;
PA.VA=n.R.T
T=0 0C or 273 K
V=11,2 Litros
P=1 atm
n=PA.VA/R.T=(1.11,2)/(22,4/273).273)=0,5mol
I es falsa.
II. N y T son constantes, por lo tanto se puede escribir;
PA.VA=PB.VB
(1.11,2)=PB.22,4
PB=0,5 atm, es cierto II
III. densidad en el punto A es;
dA=PA.Mm/R.T
Mm=(dA.R.T)/PA=(2,5.(22,4/273).273)/1
Mm=56 g/mol
1 mol de gas contiene 56 g, por lo que es cierto III.
Ejemplo: ¿Cuáles de las siguientes afirmaciones son verdaderas para los gases de Él y O2 en la misma temperatura. (He = 4, O = 16)
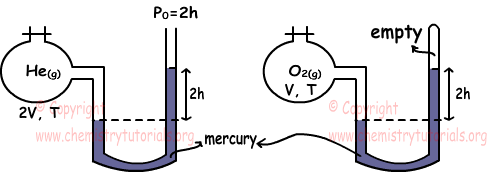
I. nHe=4nO2
II. dHe=8dO2
III. Promedio de energía cinética de Él y O2son iguales.
solución:
Nos encontramos con la presión de los gases con manómetros
PHe=2h+2h=4h
PO2=2h
Para encontrar relación entre el número de moles de gases de efecto que utilizar la ley del gas ideal.
PHe.VHe=nHe.R.THe
nHe=4h.2V/R.T
PO2.VO2=nO2.R.TO2
nO2=2h.V/R.T
Ratio de NHe y nO2
nHe/nO2=4/1 Por lo tanto, es cierto I.
Nos encontramos con la densidad de los gases una vez más usando la ley del gas ideal.
Masa molar del He = 4 y la masa molar de O2=2.16=32
dHe=PHe.MHe/R.T
dHe=4h.4/R.T
dO2=PO2.MO2/R.T
dO2=2h.32/R.T
dHe/d/O2=1/4 Por lo tanto, es falso II.
III. Dado que la temperatura de los gases mismo, su energía cinética media son también lo mismo. III es cierto.