Ley del Gas Ideal con ejemplos
Ley del Gas Ideal
n de gas ideal, las moléculas no tienen volumen y no hay interacción entre ellos. En términos reales, no hay un gas, es sólo una suposición. Todos los gases reales se ha de pequeños volúmenes y hay interacciones entre ellos. En solución de problemas; asumimos todos los gases como el gas ideal. Ecuación dada a continuación es la ley del gas ideal. Lo conseguimos mediante la combinación de todas las leyes de los gases en la sección anterior.
P.V=n.R.T
Donde, P presión, volumen V , n el número de partículas, R constante de los gases 0,08206 L atm / mol K o 22,4 / 273 L atm / mol K, y T la temperatura
Ahora que resolver algunos problemas relacionados con la ley del gas ideal para una mejor comprensión, se suceden ejemplo atentamente.
Ejemplo: Buscar la presión de 8,8 g de CO2 a 27 0C en un recipiente con volumen 1230 cm3. (C = 12, O = 16)
Solución: En primer lugar, encontrar la masa molar de CO2;
CO2=12+2.16=44
Entonces, nos encontramos con moles de CO2;
n = 8,8 / 44 = 0,2 moles
Convertir la temperatura de 0 ° C a K y el volumen de cm3 a litro;
T=27+273=300 K
V=1230 cm3=1,23 litros
Ahora, usamos la ley del gas ideal para encontrar la cantidad desconocida.
P.V=n.R.T
P.1,23=0,2.0,08206.300
P=4 atm
Ejemplo: Encontrar la masa molar de X (gas) que figura en el cuadro de abajo con 896 cm3 de volumen, temperatura de 273 °C y la masa de 0,96 g. (O = 16, y la presión atmosférica es de 1 atm)

solución:
Hacemos conversiones de unidades en primer lugar.
P=38 cm Hg=38/76=0,5 atm
V=896/1000=0,896 litros
T=273 + 273=546 K
Ahora, usamos la ley del gas ideal para encontrar n;
P.V=n.R.T
0,5.0,896=n.(22,4/273).546
n=0,03 moles
La masa molar de X;
MX=mX/n=0,96/0,03
MX=32 g/mol
Así ; X(gas)=O2
Ejemplo: Sistema A continuación se coloca en un lugar con 70 cm de Hg de presión atmosférica. Recipiente con 2 g Él al principio, luego se añade 1 g de gas H2 a este contenedor. Encontrar la salida del mercurio en el manómetro después de agregar H2. (He = 4, H2 = 2)

Pinicial=P0-20=70-20=50 cm Hg
ninicial=2/4=0,5mol He
nH2=1/2=0,5mol H2
nfinal=nHe+nH2
nfinal=0,5+0,5=1mol
Escribimos ley del gas ideal de los valores inicial y final, luego los de buceo entre sí para encontrar el valor desconocido.
V y T son constantes en ambas situaciones.
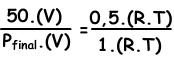
Pfinal=100 cm Hg
Diferencia entre los niveles de mercurio entre las dos ramas del manómetro;
100-70 = 30 cm en la rama derecha del manómetro
Así la diferencia entre los niveles inicial y final de Hg se convierte;
20 +30 = 50 cm
Este cambio es compartida por dos ramas del manómetro;
50 / 2 = 25 cm
Por lo tanto, se eleva 25 cm Hg en una rama de manómetro.