Mezclas y la presión parcial de gases con ejemplos
Mezclas y la presión parcial de gases con el ejemplo
Si los gases no reaccionan entre sí, producen una mezcla homogénea. Cada gas en el recipiente de presión. Ahora nos enteramos de concepto relacionado con este tema, la presión parcial.
Presión parcial:
Presión parcial de uno de los gases en la mezcla colocada en un recipiente cerrado es igual a la presión del mismo gas en el recipiente mismo a la misma temperatura. El cuadro siguiente resume lo que tratamos de decir.

Si la temperatura y el volumen de gas se mantienen constantes, la presión parcial del gas es directamente proporcional al número de partículas de gas.
Ley de Dalton de presión parcial:
“La suma de las presiones parciales de los gases en el contenedor nos da la presión total de la mezcla.” Esta declaración se llama la ley de Dalton de las presiones parciales. Cuadro que se presenta por encima de otros ejemplos de esta ley.
Ptotal =PH2+PCO2
Los gases en un mismo contenedor tiene volúmenes iguales y comparten la presión total en función del número de moles.
Si escribimos la ley del gas ideal para el total de gas en la mezcla y uno de los gases y dividirlos entre sí, obtenemos la ecuación de presión parcial de un gas en la mezcla.
P1.V = n1.R.T
¯¯¯¯ ¯¯¯¯¯¯
Ptotal.V=ntotal.R.T
P1=(n1/ntotal).Ptotal
(n1/ntotal) se llama fracción molar de gas1
P2=(n2/ntotal).Ptotal
P3=(n3/ntotal).Ptotal
. . . . . . . . . . . . . . . .
Ejemplo: En un recipiente cerrado, hay 4 gramos de H2. Si sumamos 4 El g de este contenedor, cuáles de las siguientes afirmaciones se hacen realidad? (H = 1, He = 4)
I. La presión de H2 es igual a la presión inicial de la misma.
II. Energías cinéticas de las partículas de H2 y He son iguales en la mezcla.
III. Presión parcial de H2 en la mezcla es el doble de él.
solución:
I. Encontramos presión parcial de H2, utilizando la ley de los gases ideales.
PH2.V=nH2.R.T
PH2=nH2.R.T/V
Dado que V, T y nH2 son constantes, la presión parcial de H2 no cambia. I es verdad.
II. Dado que la temperatura de la mezcla homogénea es la misma en un recipiente, las energías cinéticas de las partículas no cambian y la energía cinética de las partículas de H2 es igual a la energía cinética de las partículas de Él. II es cierto.
III. Masa molar del H2 = 2.1 = 2
Mol deH2;
nH2=4/2=2mol
Mole of He;
nHe=4/4=1mol
Presión parcial es directamente proporcional al número de moles, Así la presión parcial de H2 es el doble de la presión parcial de él. III es cierto.
Ejemplo: El contenedor contiene 0,4 mol CH4, 0,1 mol de SO2, y 0,3 mol él. Si la presión parcial de Él es de 60 cm Hg, ¿cuál de las siguientes declaraciones es falsa? (C = 12, H = 1, S = 32, O = 16)
I. Mezcla contiene 50% de CH4 en moles
II. Presión total del recipiente es de 160 cm Hg
III. Densidad del SO2 es cuatro veces la densidad de CH4
IV. Presión parcial de SO2 es de 20 cm Hg. **solución:
I. total de moles de gases;
ntotal=0,4+0,1+0,3=0,8mol
nCH4=(0,4/0,8).100=50
I es cierto
II. Presión parcial de He es de 60 cm Hg
PHe=(nHe/ntotal).Ptotal
60=(0,3/0,8).Ptotal
Ptotal=160 cm Hg
II es cierto
III. Masas molares de SO2=32+2.16=64 y CH4=12+4.1=16
masas de mSO2=nSO2.MmSO2=0,1.64=6,4 g y mCH4=nCH4.MmCH4=0,4.16=6,4 g
Como tienen volúmenes y masas iguales, d=m/V
sus densidades son también iguales, III es falsa.
IV. Presión parcial de SO2
PSO2=(nSO2/ntotal).Ptotal
PSO2=(0,1/0,8).160
PSO2=20 cm Hg IV.es cierto
La presión de los gases en los contenedores combinados
Cuadro que se presenta a continuación muestra dos contenedores en combinación con llave A.

X y Y los gases se introducen en contenedores I y II, que no reaccionan entre sí. Si abrimos el grifo entre los contenedores, que las cantidades del cambio total del sistema? Tratamos de responder a esta pregunta.
Nos enteramos de que, los gases se difunden desde la presión alta a baja presión. En este sistema de gas tiene una mayor difusión a la presión de otro recipiente hasta que la presión balance.Since no hay reacción número inicial y final de moles de gases de X e Y son iguales. Número total de moles es igual a la suma de n1 y n2.
Ecuación I. ntotal=n1+n2
Si escribimos la ley del gas ideal para cada situación;
n1=(P1.V1)/(R.T), n2=(P2.V2/R.T), ntotal=(Pfinal.Vfinal/.RT)
sustituimos estas ecuaciones en la ecuación y obtener I.;
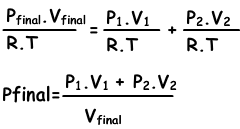
Podemos escribir V1+V2 en Vfinal también.
Ejemplo: Si abrimos el grifo y que el equilibrio del sistema, cuáles de las siguientes afirmaciones se aplica a este sistema?

I. presión final de Y es mayor que la presión inicial de Y
II. Presiones parciales de X e Y es igual.
III. La presión total se convierte en 2,4 atm
solución:
I. Volumen inicial de gas Y es 6V, el volumen final de Y es 10 V. Como la temperatura, el número de moles es constante, pero el volumen aumenta de Y, disminuye su presión. I es falsa.
II. Presiones parciales de los gases son directamente proporcionales a su número de moles. Nos encontramos con el número de moles de gases y luego le damos relación Transcurrirá sus presiones parciales utilizando la ley de los gases ideales.
n=P.V/R.T
nX=Px.Vx/R.T=3.4V/RT=12V/RT
nY=PY.VY/R.T=2.6V/RT=12V/RT
Ya que el número de moles de gases son iguales a sus presiones parciales convertido también iguales.
III. Pfinal=(Px.Vx+Py.Vy)/(Vx+Vy)
Pfinal=(3.4V+2.6V)/(4V+6V)
Pfinal=24V/10V=2,4 atm
III es cierto.