Dilución y densidad de las soluciones
Dilución y densidad de las soluciones
La dilución es el proceso de la adición de disolvente para solución. Dado que la cantidad de soluto permanece constante concentración, disminuye de solución. Encontramos relación entre la concentración de las soluciones antes y después de la dilución con la siguiente fórmula;
M1.V1=M2.V2
Donde M1 es molaridad inicial y M2 es molaridad final y V1 y V2 son los volúmenes inicial y final de la solución.
Para aumentar la concentración de las soluciones, se debe añadir soluto o evaporar el solvente de la solución. Fórmula anterior se utiliza también en la creciente concentración de las soluciones;
M1.V1=M2.V2
Concentración de las soluciones y los volúmenes son inversamente proporcionales entre sí. Si el volumen de la solución aumenta entonces, molaridad de la solución disminuye. Gráfico a continuación muestra esta relación;

Ejemplo: Si se añade 700 ml de agua a la misma temperatura a 0,2 molar de 300 ml, encontrar la concentración molar final de esta solución.
Solución:
M1 = 0,2 molar, V1 = 300 = 0,3 ml
V2 = 300 700 = 1000 ml = 1 L
M1.V1 = M2.V2
0,2.0,3 = M2.1
M2 = 0,06 molar
Ejemplo: Si mezclamos las soluciones dadas en la siguiente imagen, encontrar la concentración de la solución final.

Solución: La suma de la solución de las masas de uno y dos nos da la masa de la solución final
m1+m2=mfinal
80 + 40 =120 g
Suma de las masas de soluto uno y dos nos da la masa de soluto final.
(1) mazúcar1 + mazúcar2=mazúcarf
Nos encontramos con masas de solutos por;
mazúcar1=m1.20/100=80.1/5=16 g
mazúcar2=m2.30/100=40.30/100=12 g
mazúcarf=mfinal.X/100=120.X/100 g
usamos la ecuación (1) y resolver para X;
mazúcar1 + mazúcar2=mazúcarf
16 + 12=120.X/100 g
28=12.X/10
X=23,3
La densidad de las soluciones
Nos encontramos con la densidad de las soluciones por la siguiente fórmula;
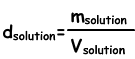
Unidad de soluciones líquidas g / ml o g/cm3. Poner soluto en agua que preparar la solución. Cuando se agrega soluto a la densidad de la solución de la misma aumenta, ya que la subida de la masa de la solución es mayor que el aumento en el volumen. En las soluciones sólido-líquido, la densidad aumenta con el aumento en la concentración de la solución.
Ejemplo: La densidad de la solución de H2SO4, que porcentaje de la masa del 49%, es de 1,2 g / mL. Buscar la concentración molar de esta solución. (H2SO4 = 98)
Solución:
densidad de la solución = 1,2 g / ml
Por ciento de la masa = 49%
Masa molar del H2SO4 es de 98 g
Nos encontramos con la concentración molar de la solución con la siguiente fórmula;
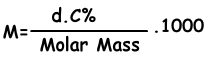
M=(1,2.4)/98 . 1000
M=6 molar
Ejemplo: La solubilidad de X a 15 oC es 20g x/100. ¿Cuáles de las siguientes afirmaciones son verdaderas para la solución preparada con 30 g X y 120 g de agua a 15 oC?
I. Solución está saturado.
II. Masa de la solución es de 150 g.
III. Por ciento de concentración de la masa es un 20%
Solución:
I. a 15 oC
100 g de agua se disuelve 20 g X
120 g de agua se disuelve? g X
¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯
? = 24 X g se disuelve.
desde 30 g X se añade al agua de 120 g, la solución está saturada y 30-24 = 6 g X se queda sin disolver. I es verdad.
II. Masa de la solución es igual a la suma de soluto y disolvente.
m=msoluto+mdisolvente
m=120+24=144
Así, la masa no es igual a 150 g, II es falso.
III. Ya que 100 g de agua se disuelve 20 g X, también hay 20 X g en 120 g de solución. Por lo tanto, el porcentaje de la masa;
X %=(mX/msolution).100
X %=(20/120).100=16,7
III es falsa