Soluciones Cheat Sheet
Soluciones Cheat Sheet
Las soluciones son mezclas homogéneas de dos o más de dos materias. Las soluciones pueden estar en estado sólido, líquido y las fases de gas. Solvente es el medio en el que la materia se disuelve y el soluto es el asunto que se disuelve en solventes. Por ejemplo, en una solución de agua con azúcar, el agua es el disolvente que disuelve el azúcar y el azúcar es el soluto que se disuelve en agua.
Diluir la solución: Soluciones con pequeña cantidad de soluto en el solvente se llaman soluciones diluidas.
Solución concentrada: Soluciones en el que gran cantidad de soluto se disuelve en el solvente.
Solvatación: Es el proceso de disolución del soluto en el solvente.
1) solvatación iónica: Si disolvente se descompone en sus iones, que llaman a estas soluciones soluciones iónicas. Ácidos, bases y sales de producir soluciones iónicas.
2) solvatación molecular: Si un asunto se descompone en sus moléculas, que llaman a estas soluciones soluciones moleculares. Disolución de azúcar en el agua es un ejemplo de solvatación molecular.
Podemos estudiar las soluciones bajo dos títulos, en función de su relación de saturación, como las soluciones saturadas y no saturadas y las soluciones de soluciones sobresaturadas.
1) Las soluciones saturadas: Si la solución se disuelve máxima cantidad de soluto a una temperatura específica, entonces los llamamos en forma de soluciones saturadas. En este tipo de soluciones no puede ser materia sólida (no disuelto) en la parte inferior del tanque.
2) Las soluciones no saturadas: Si las soluciones se pueden resolver más soluto a una temperatura específica, entonces cal que las soluciones no saturadas. Si se vaporizan una parte del disolvente o añadir un poco de soluto que puede hacer que las soluciones saturadas.
3) Las soluciones sobresaturadas: Si las soluciones contienen más soluto de su capacidad, llamamos a estas soluciones sobresaturadas soluciones. Los preparamos por el calentamiento y la adición de solución de soluto, después de que se enfríe lentamente una solución sobresaturada. Usted puede observar la cristalización de soluto en soluciones sobresaturadas.
Factores que afectan la solubilidad y la solubilidad
La solubilidad es la cantidad de soluto en 100 cm3 (100 ml) de disolventes.
Factores que afectan la solubilidad
Solventes y los tipos de soluto, temperatura, presión y efecto de ion común son factores que afectan la solubilidad.
Factores que afectan la velocidad de hidratación
Tipos de materia
Los cambios de temperatura (mayor a menor para las soluciones exotérmica y creciente de soluciones endotérmica)
Superficie de contacto (el azúcar granulado se disuelve más rápido que el azúcar cubo)
Solución de la mezcla aumenta la velocidad de hidratación.
La concentración es la cantidad de soluto en la solución dada. Podemos expresar la concentración de diferentes maneras como la concentración por ciento o por los topos.
1) Concentración por porcentaje:
Es la cantidad de soluto se disuelve en 100 g de disolvente. Si la concentración de la solución es de 20%, entendemos que hay 20 g de soluto en 100 g de solución.
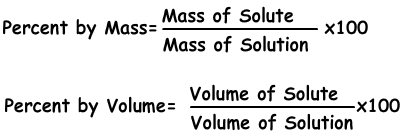
2) La concentración en moles:
Podemos expresar la concentración de soluciones por los topos. Número de moles por litro que se llama molaridad se muestra con M.
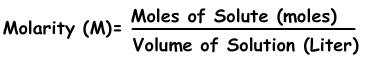
3) La molalidad:
La molalidad es la otra expresión de la concentración de las soluciones. Se denota con “m” y la fórmula de la molalidad es;
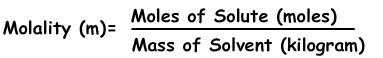
4) La normalidad:
Podemos expresar la concentración de otra manera con normalidad utilizando los equivalentes de solutos.

Dilución y densidad de las soluciones
La dilución es el proceso de la adición de disolvente para solución. Dado que la cantidad de soluto permanece constante concentración, disminuye de solución. Encontramos relación entre la concentración de las soluciones antes y después de la dilución con la siguiente fórmula;
M1.V1=M2.V2
Donde M1 es molaridad inicial y M2 es molaridad final y V1 y V2son los volúmenes inicial y final de la solución.
Para aumentar la concentración de las soluciones, se debe añadir soluto o evaporar el solvente de la solución. Fórmula anterior se utiliza también en la creciente concentración de las soluciones;
M1.V1=M2.V2
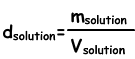
La densidad de las soluciones
Nos encontramos con la densidad de las soluciones por la siguiente fórmula;
Concentración de iones con ejemplos
Punto de ebullición, punto de congelación, presión de vapor, y propiedades como la densidad de las soluciones son diferentes de las propiedades del disolvente puro. Por ejemplo, el agua hierve a 100 oC, en la sal hierve contra una solución de agua por encima de 100 oC.
Si la materia disuelta en el agua no es volátil, que impiden la evaporación del agua y como un punto de ebullición del resultado de los aumentos de agua y punto de congelación del agua disminuye. En invierno, la sal se vierte en el camino para disminuir el punto de congelación del agua.
En una solución, el aumento de temperatura de ebullición es directamente proporcional a la concentración molar de las partículas en la solución.
En soluciones líquidas, la disminución de puntos de congelación y la presión de vapor es inversamente proporcional a la concentración molar de las partículas en la solución.
La conductividad de la electricidad es directamente proporcional a la concentración molar de los iones en las soluciones. Por ejemplo, el alcohol y el azúcar no conducen la electricidad.