La entalpía de medición y Calorímetro
Entalpía de medición y Calorímetro
La mayor parte de cambio de entalpía se puede medir experimentalmente. Este proceso se denomina “transferencia de medición de calor” calorimetría. Calorímetros son dispositivos usados en la medición de flujo de calor. En calorímetros;
El calor absorbido calor = Lanzamiento
Un calorímetro sencillo se muestra en la foto de abajo;
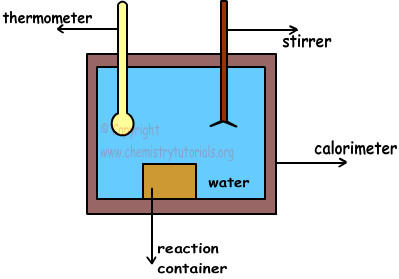
Calorímetro es un recipiente lleno de agua y insulated.Since que está aislado, no hay pérdida de calor o de transferencia con circundante. Materia se colocan en el recipiente de reacción. Con la ayuda de agitador, hacemos temperatura del agua misma en todas partes. Además, termómetro se utiliza para medir la temperatura del agua antes y después de la reacción completa.
Ti = temperatura inicial (antes de la reacción)
Tf = temperatura final (Después de la reacción)
Después de las mediciones, si;
Ti <Tf, la reacción da calor al agua y aumentar su temperatura. Por lo tanto, es la reacción exotérmica.
Ti> Tf, la reacción absorbe el calor del agua y disminuir su temperatura. Por lo tanto, es la reacción endotérmica.
El flujo de calor en calorímetro se calcula con la siguiente fórmula;
Q=mcal.ccal.∆T + magua. cagua.∆T
En caso;
mcal = masa del calorímetro, en g.
ccal = calor específico del calorímetro
magua = masa de agua en g.
cagua = capacidad de calor específico del agua
∆T= diferencia entre la temperatura inicial y final
Como ∆T es el mismo para el agua y el calorímetro, se convierte en la fórmula;
Q=(mcal .ccal + magua+ cagua). ∆T
Si escribimos;
Ccal=mcal.ccal
Cagua=magua.cagua
Q=(Ccal + Cagua). ∆T=Csistema. ∆T
Sabemos número de moles de reactantes. De acuerdo con el coeficiente de asuntos en la reacción, el valor de ΔH se calcula. Si la temperatura del sistema aumenta, entonces, la reacción es endotérmica, tomamos ΔH positivo. Si la temperatura del sistema aumenta entonces la reacción es exotérmica y ΔH se vuelve negativa.
Ejemplo: ¿Cuáles de las siguientes aplicaciones son exotérmicas?
I. X(g) + Y(g) → Z(g) + T(g)
Suma de energías de enlace de productos es mayor que la suma de energías de enlace de los reactivos.
II. Cuando el compuesto A se disuelve en agua, la temperatura del agua disminuye.
III. 2B(g) + C(g) → 2D(g)
La reacción dada anteriormente se lleva a cabo en un recipiente aislado y la presión en los aumentos de los contenedores.
Solución:
I. Si la suma de energías de enlace de los productos es mayor que las energías de enlace de los reactivos, la energía liberada de la formación de nuevo enlace en productos es mayor que la energía utilizada para romper los enlaces de los reactivos. En otras palabras, la reacción es exotérmica.
II. Si la temperatura de disminución de agua, entonces la reacción absorbe el calor del agua. Así, la reacción es endotérmica.
III. En esta reacción moles de los gases disminuye, la presión aumenta en contrario. Para aumentar la presión, la temperatura del sistema también aumentan. Así, la reacción debe ser exotérmica.
Ejemplo: entalpía de combustión de carbón es -5500 kcal / g. Para aumentar 5 kg de agua en el calorímetro de 20 0C a 42 0C, cómo muchos de kg de carbón deben ser quemados? (cagua = 1cal / g 0c)
Solución:
El calor necesario para aumentar la temperatura de 5 kg se calcula = 5.000 g de agua de 20 0C a 42 0C con la siguiente fórmula;
Q= m.c.∆T
Q=5000.1.(42-20)
Q=110000 cal
Si uno se quema el carbón g 5.500 cal de calor se libera
Si X g de carbón se quema 110.000 calor cal se libera
¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯
X = 20 g de carbón
Entalpía de las reacciones depende;
- Cantidad de materia
- Estado físico de la materia
- presión
- temperatura
- Tipos de materia