Atoom Structuur Met Voorbeelden
Atoom Structuur Met Voorbeelden
Atoom is het kleinste deeltje materie. Het bestaat uit drie deeltjes, proton, elektron en neutron genoemd. Protonen en neutronen worden in het midden van het atoom geplaatst en elektronen worden rond het midden geplaatst. De onderstaande afbeelding toont de structuur van het atoom en de locaties van protonenneutron en elektron in het atoom. 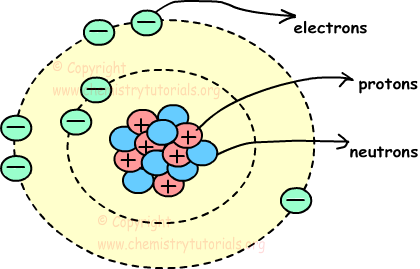
Centrum van het atoom, inclusief protonen en neutronen, wordt ook kern genoemd en cirkels rond kern worden banen genoemd.
Protonen: protonen zijn positief geladen deeltjes van atomen. Ze bevinden zich in de kern en hebben massa. We tonen protonen met de letter “p “.
Elektronen: Elektronen zijn negatief geladen bewegende deeltjes van atomen. Ze bevinden zich rond de kern op banen en hebben geen massa. We tonen elektronen met de letter “e “.
Neutronen: Neutronen zijn ladingloze deeltjes van atomen. Ze bevinden zich in de kern en hebben massa. We tonen neutronen met de letter “n “. 
Atoom Nummer:
Atoomnummer toont het aantal protonen in elk atoom. Het is specifiek voor elk atoom en wordt weergegeven met de letter “Z “. In neutraal atoom is het aantal protonen gelijk aan het aantal elektronen. Dus;
Z = p = e
Atoom nummer wordt geschreven als;
atoom nummerX
Massa Getal:
De massa van het neutron is ongeveer gelijk aan de massa van het proton. We verwaarlozen massa van elektron omdat het te klein is. De massa van het atoom is dus gelijk aan de som van de massa protonen en neutronen. We tonen het massanummer met de letter “M “. Massa aantal is niet specifiek voor elk atoom. Verschillende atomen kunnen hetzelfde massagetal hebben.
M=n+p
We tonen M op atoom als;
ZMX
Isotopen:
Isotopen hebben hetzelfde atoomnummer maar een ander massagetal. Dit betekent dat atomen hetzelfde aantal protonen hebben maar een verschillend aantal neutronen. Omdat het aantal protonen gelijk is, zijn de chemische eigenschappen van de atomen hetzelfde en zijn de neutronenaantallen verschillend. Fysieke eigenschappen van atomen zijn verschillend. Isotopen van waterstof worden hieronder gegeven; 11H,
12H ,
13H
Isotones:
Isotone atomen hebben hetzelfde aantal neutronen en verschillende aantallen protonen.
Natrium en magnesium zijn isotone atomen, hun aantal neutronen is gelijk. 1123Na en 1224Mg
Isobaren:
Isobar-atomen hebben een ander atoomnummer en een ander neutrongetal maar hetzelfde massa getal. 1124Na en 1224Mg
Omdat het aantal protonen en het aantal atomen van neutronen verschillend zijn, zijn hun fysische en chemische eigenschappen ook verschillend.
Voorbeeld: welke van de volgende beweringen zijn hetzelfde voor isotoopatomen
I. Aantal protonen
II. Aantal neutronen
III. Aantal elektronen
IV. Atoom nummer
V. Chemische eigenschappen
VI. Fysieke eigenschappen
Isotopen hebben hetzelfde atoomnummer maar een ander massagetal. Dit betekent dat isotopenatomen een gelijk aantal protonen en een verschillend aantal neutronen hebben. Als het atoom neutraal is, is het aantal protonen in het atoom gelijk aan het aantal elektronen. Omdat het aantal protonen van atomen gelijk is en het aantal neutronen verschillend is; chemische eigenschappen van deze atomen zijn hetzelfde, maar fysische eigenschappen ervan zijn verschillend. Dus;
I. III. IV. en V is waar voor isotopenatomen.
Voorbeeld: zoek het aantal protonen van een atoom met massa nummer 65 en neutron nummer 35.
Massa aantal is gelijk aan de som van protonen en neutronen. M=p+n
65=35+p
p=30
Voorbeeld: welke van de volgende beweringen zijn waar voor 1224X en 1124Y atomen.
I. Aantal protonen X> Y
II. neutronennummer van Y is groter dan neutronennummer van X
III. Hun massa’s zijn gelijk
1224X :
X heeft 12 protonen en
24-12 = 12 neutronen
Massa aantal = 1124Y:
Y heeft 11 protonen en
24-11 = 13 neutronen
Massa aantal = 24
Aldus I. II. en III. zijn waar.
Voorbeeld:
I. 2656Fe+2, 2656Fe+3
II. 2656Fe, 2756Co
III. H2O, D2O
Welke van de hierboven genoemde paren heeft dezelfde chemische eigenschappen. (11H, 12D)
Om dezelfde chemische eigenschappen te hebben, moeten ze een gelijk aantal protonen en elektronen hebben.
I. Beiden hebben hetzelfde aantal proton 26, maar hun elektronentallen zijn verschillend. De eerste heeft 26-2 = 24 elektronen en de tweede heeft 26-3 = 23 elektronen. Ze hebben dus verschillende chemische eigenschappen.
II. Omdat beide een verschillend aantal protonen en elektronen hebben, hebben ze verschillende chemische eigenschappen.
III. In dit koppel hebben ze een gelijk aantal protonen en elektronen hebben ze dezelfde chemische eigenschappen.