Elektronen Configuratie Met Voorbeelden
Elektronen Configuratie Met Voorbeelden
Elektronen worden niet op vaste posities in atomen geplaatst, maar we kunnen geschatte posities ervan voorspellen. Deze posities worden energieniveaus of omhulsels van atomen genoemd.
- Laagste energieniveau is 1 en het wordt aangegeven met een geheel getal n = 1, 2, 3, 4, 5, 6 … of letters beginnend met K, L, N tot Q. Een atoom kan maximaal 7 energieniveaus hebben en elektronen kunnen verander hun niveaus volgens hun energieën.
- Elk energieniveau heeft een ander aantal elektronen. We kunnen bijvoorbeeld het aantal elektronen vinden in vier energieniveaus met de volgende formule; 2n2.
1e energieniveau heeft;
2n2 = 2.12 = 2 elektronen
2e energieniveau heeft;
2n2 = 2.22 = 8 elektronen 3e energieniveau heeft;
2n2=2.32=18 electronen
- Elektronen bevinden zich energieniveaus vanaf de eerste energieniveaus. Als een van de energieniveaus vol is, worden elektronen geplaatst volgens het energieniveau.
De volgende afbeeldingen tonen de locatie van elektronen van atomen O en Mg. 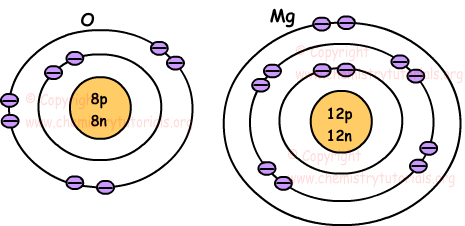
Aantal elektronen aan de buitenkant van het atoom geeft ons de volgende classificatie.

Elektronenconfiguratie van atoomshows, shells, subshells en aantal elektronen in subshells. We onderzoeken de elektronenconfiguratie met de volgende voorbeelden.
Voorbeeld: Helium 2 1s2
Waar;
1 is het hoofdkwantumgetal of energieniveau (schaal)
s is het subniveau of de subshell (capaciteit van de subshell is 2 elektron)
2 toont het aantal elektronen in de subschil van s
Voorbeeld: Chloor 17 1s22s22p63s23p5
Coëfficiënten 1, 2, 2, 3 en 3 zijn energieniveaus van Cl. Zoals je kunt zien, kan de “p” subshell maximaal 6 elektronen hebben.
Superscripts 2, 2, 6, 2 en 5 zijn elektronen in de subshells “s” en “p”.
Voorbeeld: Bromine 35
1s22s22p63s23p64s23d104p5
Zoals je kunt zien, kan “d” subshell maximaal 10 elektronen hebben.
Voorbeeld: Tantalum
73 1s22s22p63s23p64s23d104p65s24d105p66s24f145d3
Zoals je kunt zien, kan de “f” -subshell maximaal 14 elektronen hebben.