Gassen Examen 3 En Probleem Oplossingen
Gassen Examen 3 En Probleem Oplossingen
1. Zoek een volume van 0,5 mol CH4 onder een druk van 3,28 atm en een temperatuur van 400 0K.
Oplossing: P=3,28 atm, n=0,5mol, T=400 0K, R=0,082, V=?
We gebruiken de ideale gaswet;
P.V=n.R.T
3,28.V=0,5.0,082.400
V = 5 liter
2. Als 6,4 g CH4 een druk heeft van 0,5 atm en een volume van 2 liter, zoek dan een druk van 9 g C2H6 met 1 liter volume onder constante temperatuur. (C = 12, H = 1)
Oplossing:
We vinden eerst de mol van gegeven zaken; nCH4=6,4/16=0,4mol
nC2H6=9/30=0,3mol
Omdat de temperatuur constant is, schrijven we de ideale gaswet zoals hieronder aangegeven;
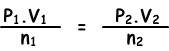
(0,5.2)/0,4=(P2.1)/0,3
P2=0,75 atm
or P2= 57 cm Hg
3. Zoek dichtheid van O2 onder 27 0C temperatuur en 1,23 atm druk. (O = 16)
Oplossing: T=27 + 273=300 0K
Als we ideale gaswet voor dichtheid schrijven, krijgen we de volgende vergelijking;
d=(P.M)/(R.T)
waarbij M een molmassa van O2.
d=(1,23.32)/(0,082.300)
d=1,6g/liter
4. Als we de kranen openen die in de onderstaande afbeelding worden weergegeven, zoek dan de eindtemperatuur van gassen.

Oplossing:
We gebruiken de volgende vergelijking om de uiteindelijke druk van het gasmengsel te vinden;
P1.V1 + P2.V2 + P3.V3 = Pfinal.Vfinal
3.2 + 4.3 + 0.5 =Pfinal.(2+3+5)
6 + 12=Pfinall.10
Pfinal=1,8 atm
5. Wanneer we de kranen openen die in de onderstaande afbeelding worden weergegeven, vinden we veranderingen in de druk van gassen.

Oplossing:
We moeten de uiteindelijke druk van het systeem vinden om een vergelijking te maken.
P1.V1 + P2.V2 + P3.V3 = Pfinal.Vfinal
P.V + 2P.2V + 3P.V = Pfinal.(V+2V+V)
Pfinal=2P
Dus,
I. Druk van verhoging eerste container
II. De druk van de tweede container blijft constant
III. Druk van derde container neemt af