Chemische Banden
Chemische Banden
Bindingen
Het bij elkaar houden van atomen en moleculen wordt binding genoemd. Atomen komen samen en worden stabieler en er komt energie vrij tijdens dit proces. We kunnen dus zeggen dat alle bindingsreacties exotherm zijn. Integendeel, alle breekreacties zijn endotherm. Valence-elektronen van atomen en moleculen spelen een rol bij binding. Als binding atomen samenbindt, noemen we het chemische binding . Als binding moleculen echter samenbindt, noemen we het moleculaire binding .
Chemische Bindingen:
Er zijn twee soorten chemische bindingen;
- Ionische Binding
- Covalente Binding
Hoewel elementen verbindingen vormen, hebben ze de neiging een elektronconfiguratie van edelgassen te hebben. Behalve He beëindigen alle edelgassen hun elektronenconfiguratie met ns2np6. Met andere woorden, alle granaten van edelgassen zijn gevuld. Ze zijn te stabiel. Atomen willen ook stabiel zijn en hun aantal valentie-elektronen voltooien tot 8.
Lewis Structuren Atomen
Representaties van het valentie-elektron rond het symbool van elementen met stippen. Bijvoorbeeld;
11Na=1s22s22p63s1
Zoals je kunt zien, heeft Na één valentie-elektron in zijn buitenste schil. We tonen het met de Lewis-formule;
Na ●
Aan de andere kant als 1s, 2s en 2p orbitalen vol zijn, worden ze niet weergegeven met de Lewis-formule.
Voorbeeld: 17Cl schrijf Lewis-formule van Cl atoom.
17Cl=1s22s22p63s23p5
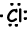
Valence-elektronen van ionen kunnen ook worden weergegeven met de Lewis-formule. Bijvoorbeeld;
Lewis-formule van 9F-1 is;
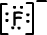
1. Ionische Binding:
Het is de band tussen positief en negatief geladen ionen. Metalen en niet-metalen atomen komen samen met ionische binding. Metaalatoom verliest elektron en wordt positief geladen en niet-metalen atoom accepteert elektron en wordt negatief geladen. Krachten bij elkaar houden is elektrostatisch aantrekkelijke kracht.
- In periodiek systeem A verliezen metalen uit de groep elektronen die gelijk zijn aan hun groepsnummer. Bijvoorbeeld; metalen in I A verliezen 1 elektron en worden +1 ion, metalen in II A verliezen 2 elektronen en worden +2 ion, metalen in III A verliezen 3 elektronen en worden +3 ion.
- Niet-metalen accepteren elektron dat zijn valentie-elektronen voltooit tot edelgassen. Bijvoorbeeld; niet-metalen in VA groep accepteren 3 elektronen en worden -3 ion, niet-metalen in VI A groep accepteren 2 elektronen en worden -2 ion, niet-metalen in VII A groep accepteren 1 elektron en worden -1 ion.
- Tijdens het ionenbindingsproces is het aantal geaccepteerde elektronen gelijk aan het aantal verloren elektronen.
Voorbeeld: Analyseer binding tussen NaCl molecuul.
11Na verliest 1 elektron en wordt Na+. 17Cl accepteert één elektron en wordt Cl-. Aantrekking tussen tegenovergestelde ionen vormt ionische binding.
- De sterkte van ionbinding is direct gerelateerd aan de neiging om elektron van metalen te verliezen en elektron van niet-metalen te accepteren.
2. Covalente Binding:
Als atomen hun valentie-elektronen delen tijdens het bindingsproces, noemen we het covalente binding. Er is geen elektronenoverdracht. Dit type binding wordt gezien tussen twee of meer niet-metalen atomen. Om covalente binding te hebben, moeten atomen ten minste een half gevulde orbitaal hebben. Covalente binding tussen H2molecuul wordt hieronder getoond; 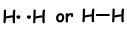
- Aantal covalente bindingen is gelijk aan aantal halfgevulde orbitalen.
- De eerste covalente binding tussen twee atomen wordt sigma-binding genoemd en wordt getoond met “σ “.
- Er is slechts één sigma-binding tussen twee atomen en andere bindingen worden pi-bindingen genoemd en worden getoond met “π”.
Voorbeeld: Analyseer binding tussen O2 molecuul.
8O=1s22s22p4
Of tonen met orbitaal en Lewis-puntenschema;

Zoals u kunt zien in een orbitaal schema en Lewis-puntformule O heeft twee half gevulde orbitalen en kan het twee bindingen doen. Eerste binding heet sigma en werd hieronder getoond;
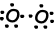
Deze O atomen delen hun tweede elektronen en worden O2 molecuul;
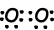
Voorbeeld: Covalente bindingen van NH3 tonen.
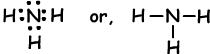
Voorbeeld: Welke van de volgende beweringen is onwaar voor 8O element.
I. Het is niet-metalen
II. Het kan twee bindingen doen
III. In elektronenconfiguratie in grondtoestand heeft het twee gevulde orbitalen
IV. Ik heb covalente binding met 9F element.
V. Het vormt een ionbinding met 11Na en vormt een verbinding; Na2O
Oplossing:
8O heeft elektronenconfiguratie in grondtoestand; 
I. Aangezien het aantal valentie-elektronen van 8O 6 is, is het niet-metaal. waar
II. Het heeft twee halfgevulde orbitalen, dus het kan twee bindingen doen. waar
III. Zoals u kunt zien in het orbitale schema, heeft 8O 3 gevulde orbitalen in grondtoestand. vals
IV. 9F heeft elektronenconfiguratie in grondtoestand;
F: 1s22s22p5
F heeft 7 valentie elektronen en is dus niet-metalen. We hebben geleerd dat twee niet-metalen atomen samenkomen met covalente binding. waar
V. 11Na heeft een elektronenconfiguratie in grondtoestand;
Na: 1s22s22p63s1
Na geeft één elektron en wordt Na+ en O accepteert 2 elektronen en wordt O-2. Aldus is de binding daartussen een ionische binding. Waar.