Polariteit Van Banden
Polariteit Van Banden
In bindingen, die zich vormen tussen twee hetzelfde atoom, worden elektronen aangetrokken door gelijke krachten. We noemen deze obligaties niet-polaire covalente obligaties. H2, O2 en N2 hebben een niet-polaire covalente binding. Als covalente binding wordt gevormd tussen twee verschillende atomen met verschillende elektronegativiteit, wordt kracht die op de gedeelde elektron werkt door de atomen anders. Dit soort bindingen worden polaire covalente bindingen genoemd. HCl, HF, CO zijn voorbeelden van polaire covalente binding. Moleculen met polaire bindingen kunnen polair of niet-polair zijn. Om een idee te krijgen of een molecuul polair of niet-polair is, moet u naar de geometrie van de moleculen kijken.
Hybridisatie En Bonding Geometry
We hebben geleerd dat atomen bindingen kunnen vormen die gelijk zijn aan het aantal halfgevulde orbitalen. Integendeel, als we kijken naar molecuulgeometrie of onverwacht aantal bindingen van II A-, III A- en IV A-groepen, leggen we dit uit met een ander concept dat hybridisatie wordt genoemd. Nu onderzoeken we elke groepselementen en hun bindingscapaciteiten met behulp van dit concept.
I A Groep Bindingen:
Li element is een voorbeeld van I A groep, laat me de binding tussen Li en H atomen onderzoeken.
Elektronen configuratie van Li is; Li: 1s22s1
Zoals je kunt zien, heeft Li een halfgevulde orbitaal en kan ze één binding vormen. Aldus delen Li en H één elektron en vormen de volgende binding;
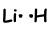
Deze molecule is lineair en polair. Zoals je kunt raden, zijn alle diatomeeënmoleculen lineair.
II A Groep Bindingen: (sp Hybridisatie)
Wees element in deze groep vormt banden met H en F; BeH2 en BeF2. Elektronen configuratie van Be is;
Be: 1s22s2
Zoals het te zien is in de elektronenconfiguratie, heeft Be geen halfgevulde orbitalen. We verwachten dat het geen band kan vormen. Integendeel, experimenten die hieruit zijn gedaan, laten zien dat hybridisatie Be-bindingen maakt.
Tijdens het vormen van een binding, heeft een elektron in 2s orbitaal overgebracht naar de 2p orbitalen en Be heeft twee halfgevulde orbitalen en heeft het vermogen om 2 bindingen te vormen. Omdat de elektronen zich in verschillende orbitalen bevinden (2s en 2p), verwachten we dat hun eigenschappen verschillend zijn. Integendeel, experimenten tonen aan dat deze obligaties dezelfde kenmerken hebben, ze zijn hetzelfde. Dit wordt ook verklaard met hybridisatie.
Deze orbitalen stoten elkaar af en worden geplaatst met een hoek van 180 0 ten opzichte van elkaar en vormen volgende bindingen; 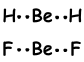
Deze molecule is lineair en niet-polair. Banden zijn polair maar equivalente kracht die op Be werkt met een hoek van 180 0 is nul, dus molecuul is niet-polair.
III A Groep Bindingen:(sp2 hybridisatie)
5B element in deze groep vormt banden met H en F; BeH3 en BeF3. Elektronen configuratie van B is;
B: 1s22s22p1
Zoals gezien vanuit de elektronenconfiguratie, heeft B een halfgevulde orbitaal en kan één binding vormen. Maar we zien dat het 3 bindingen vormt. Dit is een voorbeeld van sp2 hybridisatie. Eén elektron van 2s orbitaal wordt overgebracht naar 2p orbitaal en het heeft nu 3 half gevulde orbitalen en kan 3 binding vormen. Deze drie bindingen zijn weer hetzelfde als in het geval van sp-hybridisatie en door elkaar af te stoten bevinden ze zich met een hoek van 120 °. We tonen deze elektronen en binding met de Lewis-stipformule;
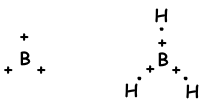
Molecuul heeft trigonale vlakke geometrie. Dit molecuul is ook niet-polair ondanks dat alle bindingen polair zijn. Aangezien elektronen met een hoek van 120 ° worden geplaatst, is de equivalente kracht daarvan nul, dus is het molecuul niet-polair.
IV A Groep Bindingen:(sp3 hybridisatie)
6C element in deze groep vormt bindingen met H en F; CH4 en CF4. Elektronen configuratie van C is;
C: 1s22s22p2
Zoals gezien vanuit de elektronenconfiguratie heeft C twee halfgevulde orbitalen en kan twee bindingen vormen. Maar we zien dat het 4 bindingen vormt. Dit is een voorbeeld van sp3 hybridisatie. Eén elektron van 2s orbitaal wordt overgebracht naar 2p orbitaal en heeft nu 4 halfgevulde orbitalen en kan nu 4 bindingen vormen. Deze vier bindingen zijn weer hetzelfde als in het geval van sp2 hybridisatie en door elkaar af te stoten bevinden ze zich met een hoek van 109 °. We tonen deze elektronen en binding met de Lewis-stipformule;
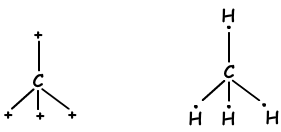
Deze moleculen hebben tetraëdrische vorm en ze zijn niet-polaire moleculen.
V A Groep Bindingen:(sp3 hybridisatie)
7N element in deze groep vormt banden met H; NH~sub~3">}}. Elektronen configuratie van N is;
N: 1s22s22p3
Door naar de orbitale structuur van dit element te kijken, zeggen we dat het 3 bindingen kan vormen en dat hybridisatie niet nodig is. Integendeel, experimenten op dit element tonen aan dat hybridisatie moet plaatsvinden om een hoek van 107 ° tussen bindingen te hebben. Aldus worden één 2s en drie 2p orbitalen gemengd en vier sp3 hybride orbitaal. Een van deze orbitalen heeft 2 elektronen en verbindt niet met elkaar, maar het verandert van hoek in het geval van tetraëdrische 109 ° tot 107 ° en vormt een nieuwe vorm “trigonaal piramidaal”. Omdat ladingen niet gelijk verdeeld zijn, is dit molecuul polair. Vorm van NH3 bindingen;
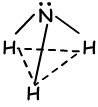
VI A Groep Bindingen: (sp3 hybridisatie)
8O element in deze groep vormt banden met H en F; H2O en OF2. Elektronenconfiguratie van O is;
O: 1s22s22p4
Zuurstof kan twee bindingen vormen, maar experimenten tonen aan dat de hoek tussen bindingen 104,5 0 is, dit kan alleen mogelijk zijn met hybridisatie. Een s en 3 p orbitalen worden gemengd en 4 sp hybride orbitalen worden gevormd. Deze vier orbitalen bevatten 6 elektronen en 2 van de orbitalen zijn half gevuld en ze vormen 2 bindingen. Vorm van molecuul wordt gebogen en molecuul is polair.
Voorbeeld: Waarin een van de volgende verbindingen, zowel molecuul als bindingen polair zijn. (4Be, 5B, 6C, 8O, 16S, 17Cl)
I. BeCl2
II. CO2
III. SCl2
IV. BCl3
V. CCl4
Oplossing:
I. Lewis-stipformule van BeCl2 wordt hieronder gegeven; 
De vorm van het molecuul is lineair en niet-polair.
II. Lewis-stipformule van CO2 wordt hieronder gegeven; 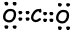
De vorm van het molecuul is lineair en niet-polair.
III . Lewis-stipformule van SCl2 wordt hieronder gegeven; 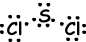
De resulterende bindingsvector is niet nul, dus is het molecuul polair en zijn bindingen ook polair.
IV. De Lewis-stipformule van BCl3 wordt hieronder gegeven; 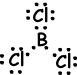
Vorm van molecuul is trigonaal vlak. Omdat de resulterende bindingsvector nul is, is het molecuul niet-polair.
V. Lewis-puntformule van CCl4 wordt hieronder gegeven; 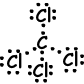
Vorm van molecuul is tetraëdrisch en molecuul is niet-polair.
Aldus zijn zowel bindingen als structuur van molecuul van SCl2 polair.