Cheatsheet Voor Gassen
Cheatsheet Voor Gassen
Gassen
Gas is een van de fasen van materie. Afstanden tussen atomen of moleculen in gasfase zijn groter dan vaste stoffen en vloeistoffen.
Volume (V)
Volume van gas is gelijk aan volume van container. Ze hebben geen specifieke volumes. Onder standaard temperatuur en druk heeft 1 mol gas een volume van 22,4 liter. De volume-eenheden die we hier gebruiken, zijn liter.
Temperatuur (T)
In berekeningen van gassen wordt absolute temperatuur (K) gebruikt. In -273 is diffusie van gassen nul en in de natuur is Kelvin de eenheid van temperatuur en de relatie tussen K en 0C is;
Druk:
Druk is de kracht die loodrecht op het oppervlak van de eenheid werkt. Eenheid van druk is mm Hg, cm Hg of atm. In het algemeen wordt (atmosferische druk) atm gebruikt. 
Laat P0 dan de atmosferische druk zijn;
P0= h cm Hg
P0 = 76 cm Hg op zeeniveau.
h hangt af van;
dichtheid van de vloeistof die in de container wordt gedaan
h hangt niet af van de doorsnede van de buis.
De gasdruk in een gesloten container is overal gelijk. Manometers worden gebruikt voor het meten van de gasdruk in een gesloten container. Er zijn twee soorten manometers, manometers met gesloten uiteinde en manometers met open uiteinde
Kinetische Theorie Van Gassen
Kinetische theorie is een model dat zich bezighoudt met beweging van gasatomen / moleculen in een gesloten container.
- Gasmoleculen of atomen doen willekeurige bewegingen in de container.
- Tijdens deze willekeurige beweging botsen ze tegen elkaar en op het oppervlak van de container.
- Ze diffunderen homogeen in de container. Als we twee verschillende gassen in dezelfde container stoppen, produceren ze een homogeen mengsel.
- Ruimten tussen moleculen en atomen in gassen zijn groter dan ruimtes tussen deeltjes in vaste stoffen en vloeistoffen.
- Op hetzelfde moment zijn snelheden van gasatomen / moleculen niet gelijk. Ze zijn omgekeerd evenredig met de vierkantswortel van moleculaire massa en rechtstreeks evenredig met de vierkantswortel van absolute temperatuur.
- Bij dezelfde temperatuur zijn de gemiddelde kinetische energieën van alle atomen / moleculen gelijk.
- Botsingen van gasatomen / moleculen met elkaar en het oppervlak van de container zijn elastisch, er gaat dus geen energie verloren.
- De aantrekkingskracht tussen gasatomen / moleculen is zwak.
Effusie En Diffusie Van Gassen
Diffusie:
Het mengen van moleculen van het ene gas met moleculen van een ander gas wordt diffusie genoemd. Geur van een parfum of maaltijd in een kamer zijn enkele veel voorkomende voorbeelden van diffusie van gassen. Gassen hebben verschillende diffusiesnelheden bij verschillende temperaturen. De volgende formule toont de verhouding van diffusiesnelheden van twee gassen bij dezelfde temperatuur.
Diffusiesnelheid (r) is recht evenredig met de gemiddelde moleculaire snelheid. 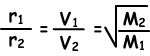
Waar; r1 en r2 zijn diffusiesnelheden van gas1 en gas2, V1 en V2 zijn gemiddelde moleculaire snelheden van gassen en M1 en M2 zijn moleculaire massa’s van gassen.
Effusioe: 
Zoals u op de bovenstaande afbeelding kunt zien, wordt de beweging van de gassen van de ene container naar de andere door een klein gaatje te passeren effusie genoemd (zoals op de foto, is de tweede container over het algemeen leeg of vacuüm). Diffusie vindt plaats onder constante druk daarentegen vindt effusie plaats onder drukverschil tussen houders.
1. Wet van Boyle: (Druk-volume relatie)
We kunnen de wet van Boyle definiëren;
“Onder constante temperatuur en aantal deeltjes zijn druk en volume van gassen omgekeerd evenredig met elkaar.”
V is omgekeerd evenredig met P of
P.V = constante
Bovendien;
P1.V1=P2.V2=P3.V3 = .. (voor hetzelfde gas bij constante temperatuur en aantal deeltjes.)
2. De wet van Charles: (relatie volume-temperatuur)
Onder constant aantal deeltjes en druk is het volume van het gas recht evenredig met de absolute temperatuur. Deze verklaring wordt “de wet van Charles " genoemd. V / T = constant (aantal deeltjes “n” en drukconstante “P”)
3. Wet van Gay Lussac / Amonton: (Druk-temperatuur relatie) Wanneer we de temperatuur van het gas verhogen, geplaatst in een container met een constant volume, neemt de snelheid van gasmoleculen toe. Toename van de snelheid van moleculen verhoogt het aantal botsingen met oppervlakken, dit is druk. Met andere woorden, het verhogen van de temperatuur van het gas onder constant volume en aantal deeltjes, verhoogt de druk van het gas.
Dus; P1/T1=P2/T2
4. Wet van Avogadro: (volume-aantal deeltjesrelatie)
Gassen met gelijke druk en temperatuur hebben een gelijk aantal deeltjes in gelijke hoeveelheid volumes. Met andere woorden, volume en aantal deeltjes van gassen zijn recht evenredig met elkaar. We zeiden in eerdere onderwerpen dat 1 mol gas 22,4 liter is onder standaard druk en temperatuur en 1 mol gas 6,02x1023 moleculen / atomen bevat.
V/n=constante;
V1/n1=V2/n2 (P en T constante)
5. Wet van Dalton: (Druk-aantal deeltjes relatie)
Toenemend aantal deeltjes in een gesloten container, verhoogt de gasdruk. Met andere woorden, de druk van gassen is recht evenredig met mol ervan onder constant volume en temperatuur.
P/n=constante;
P1/n1=P2/n2
n ideaal gas; moleculen hebben geen volume en er is geen interactie tussen hen. In het echt bestaat zo’n gas niet, het is slechts een veronderstelling. Alle echte gassen hebben kleine volumes en er zijn interacties tussen hen.
P.V=n.R.T
Waar; P druk, V volume, n aantal deeltjes, R gasconstante 0,08206 L atm / K mol of 22,4 / 273 L atm / K mol, en T temperatuur
De dichtheid van gassen is te klein met betrekking tot vaste en gasfasen. We kunnen dichtheid vinden met de volgende formule;
d (gas) = m (gas) / V (gas)
als we het vervangen door de ideale gaswet;
P.V = n.R.T waarbij n = massa / molaire massa P.V=(m/Mm).R.T
P.Mm=(m/V).R.T
P.Mm=d.R.T
d=(P.Mm)/(R.T)
Mengsels En Partiële Druk Van Gassen
Als gassen niet met elkaar reageren, produceren ze een homogeen mengsel.
Gedeeltelijke Druk:
De partiële druk van een van de gassen in een mengsel geplaatst in een gesloten container is gelijk aan de druk van hetzelfde gas alleen in dezelfde container bij dezelfde temperatuur. 
Dalton’s Wet Van Gedeeltelijke Druk:
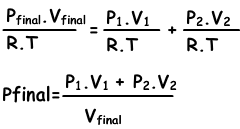
“Som van gedeeltelijke drukken van de gassen in de container geeft ons totale mengdruk.” Deze verklaring wordt de wet van Dalton van gedeeltelijke druk genoemd. Afbeelding hierboven ook voorbeelden van deze wet.
Ptotal=PH2+PCO2
Mengsels van gassen kunnen worden gevonden met de volgende vergelijking;