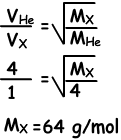Effusie en diffusie van gassen met voorbeelden
Effusie en diffusie van gassen met voorbeelden
Diffusion:
Het mengen van moleculen van het ene gas met moleculen van een ander gas wordt diffusie genoemd. Geur van een parfum of maaltijd in een kamer zijn enkele veel voorkomende voorbeelden van diffusie van gassen. Gassen hebben verschillende diffusiesnelheden bij verschillende temperaturen. De volgende formule toont de verhouding van diffusiesnelheden van twee gassen bij dezelfde temperatuur.
Diffusiesnelheid (r) is recht evenredig met de gemiddelde moleculaire snelheid. 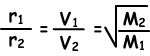
Waar; r1 en r2 zijn diffusiesnelheden van gas 1 en gas 2, V1 en V2 zijn gemiddelde moleculaire snelheden van gassen en M1 en M2 zijn moleculaire massa’s van gassen.
De hierboven gegeven vergelijking wordt ook wel “Graham’s Diffusion Law” genoemd.
Nu geven we de diffusieverhouding van twee verschillende gassen bij verschillende temperaturen. Laat T1 en T2 absolute temperaturen van gassen zijn. 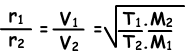
Op te sommen;
Snelheid van gasdiffusie;
- is omgekeerd evenredig met de vierkantswortel met molaire massa
- is recht evenredig met de vierkantswortel van absolute temperatuur
Dus;
Als gassen dezelfde temperatuur hebben, heeft één met een kleinere molmassa een grotere diffusiesnelheid. Als gassen een gelijke molmassa hebben, heeft één met een hogere temperatuur een grotere diffusiesnelheid.
Effusie

Zoals u op de bovenstaande afbeelding kunt zien, wordt de beweging van de gassen van de ene container naar de andere door een klein gaatje te passeren effusie genoemd (zoals op de foto, is de tweede container over het algemeen leeg of vacuüm). Diffusie vindt plaats onder constante druk daarentegen vindt effusie plaats onder drukverschil tussen houders. De effusiesnelheid van gassen verandert volgens de diffusiewet van Graham. Nu lossen we enkele voorbeelden op met betrekking tot diffusie en effusie van gassen.
Voorbeeld: Als gassen X en SO2 tegelijkertijd worden verzonden vanuit de punten A en B, komen ze samen op punt 20 cm van B. Welke van de volgende beweringen is waar? (SO2 = 64)
I. Molaire massa van X is 4
II. Als we de absolute temperatuur van SO2 verhogen en de temperatuur van X constant houden, komen het ontmoetingspunt van gassen dichter bij A.
III. Als we de absolute temperatuur van gassen met dezelfde hoeveelheid verlagen, verandert het ontmoetingspunt niet. 
Oplossing:
I. Aangezien het ontmoetingspunt van gassen 20 cm verwijderd is van B, bewegen moleculen van X 4 keer sneller dan moleculen van SO2. 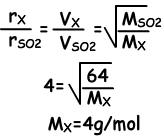
I is waar
II. SO2 beweegt langzamer dan X, als we de temperatuur van SO2 verhogen, neemt de snelheid toe en komt het ontmoetingspunt dichter bij punt A. II is ook waar.
III. Het verlagen van de temperatuur van gassen in dezelfde hoeveelheid heeft geen invloed op het trefpunt. III is waar
Voorbeeld: Welke van de volgende beweringen geldt voor de gemiddelde moleculaire snelheid van H2 en N2 moleculen. (H = 1, N = 14)
I. N2 moleculen bij 40 ° C zijn langzamer dan H2 moleculen bij 40 ° C.
II. H2 moleculen bij 80 ° C zijn langzamer dan N2 moleculen bij 40 ° C.
III. N2 moleculen bij 80 ° C zijn sneller dan H2 moleculen bij 40 ° C.
Oplossing:
Molaire massa H2 = 2 g / mol, Molaire massa N2 = 28 g / mol.
I. Aangezien de molmassa van N2 groter is dan H2, bewegen N2 moleculen langzamer dan H2. I is waar
II. Gemiddelde moleculaire snelheid is recht evenredig met vierkantswortel van absolute temperatuur. Aldus zijn H2 moleculen sneller dan N2 moleculen. II is waar
III. Moleculen van N2 bij 80 ° C zijn sneller dan moleculen van H2 bij 40 ° C. III is waar.
Voorbeeld: Bij constante temperatuur ontmoeten de kranen elkaar bij punt A. Vind de moleculaire massa van X (gas).
Oplossing:
Omdat ze elkaar ontmoeten op punt A, zijn moleculen van Hij sneller dan moleculen van X. Gedurende dezelfde tijd neemt Hij 4 eenheden afstand, X neemt 1 eenheden afstand.