Eigenschappen Van Oplossingen En Oplossing Berekeningen
Eigenschappen Van Oplossingen En Oplossing Berekeningen
Eigenschappen Van Oplossingen
- Kookpunt, vriespunt, dampdruk en eigenschappen zoals dichtheid van oplossingen verschillen van eigenschappen van puur oplosmiddel. Water kookt bijvoorbeeld bij 100 ° C, integendeel, zoutoplossing kookt boven 100 ° C.
- Als opgeloste stoffen in water niet vluchtig zijn, voorkomen ze verdamping van water en als gevolg daarvan stijgt het kookpunt van water en neemt het vriespunt van water af. In de winter wordt zout op de weg gegoten om het vriespunt van water te verlagen.
- In een oplossing is het stijgende kookpunt recht evenredig met de molaire concentratie van deeltjes in oplossing.
- In vloeibare oplossingen is het verlagen van vriespunten en dampdruk omgekeerd evenredig met de molaire concentratie van deeltjes in oplossing.
- Geleidbaarheid van elektriciteit is recht evenredig met molaire concentraties van ionen in oplossingen. Alcohol en suiker geleiden bijvoorbeeld geen elektriciteit.
Voorbeeld: Er zijn gelijke hoeveelheden water in de volgende tanks. Als we de volgende opgeloste stoffen in deze tanks oplossen; zoek een verband tussen de elektrische geleidbaarheid van deze oplossingen.
I. 1 mol NaCl
II. 2 mol suiker
III. 1 mol Al(NO3)3

Oplossing:
Elektrische geleidbaarheid van oplossingen hangt af van de molaire ionenconcentratie van de oplossing. Nu vinden we ionconcentratie van oplossingen in elke tank.
I. NaCl(s) → Na+(aq) + Cl-(aq)
1 mol 1 mol 1 mol
Er is 2 mol ion in de eerste oplossing.
II. Omdat suiker moleculaire solvatatie doet, is er geen ion in de oplossing. Het geleidt dus geen elektriciteit.
III.
Al(NO3)3(s) → Al+3 + 3NO3-1
1 mol 1 mol 3 mol
Er zit 4 mol ion in deze oplossing.
Volumes van oplossingen zijn gelijk aan elkaar, dus wordt de relatie tussen elektrische geleidbaarheid van oplossingen;
III>I>II
Oplossingen Berekeningen
Voorbeeld: Als we 3 oplossingen bereiden onder 1 atmosfeer druk met behulp van 1 1 water en 0,1 mol NaCl, 0,2 mol NaCl, 0,3 mol NaCl voor elke oplossing, vergelijk kookpunt, vriespunt en dampdruk van deze oplossingen. 
Oplossing:
NaCl(s) → Na+(aq) + Cl-(aq)
1 mol NaCl geeft 1 mol Na+ en 1 mol Cl- totaal 2 mol ionen.
In eerste container; 0,1 NaCl geeft 0,2 mol ion
In tweede container; 0,2 NaCl geeft 0,4 mol ion
In derde container; 0,3 NaCl geeft 0,6 mol ion
Kookpunten van oplossingen. Kookpunt van de oplossing. Relatie tussen kookpunten van oplossing; III>II>I
Als het kookpunt van de oplossing hoog is, is de dampspanning ervan laag. Aldus wordt de relatie tussen dampdrukken van oplossingen;
I>II>III
Als het kookpunt van de oplossing hoog is, dan is het vriespunt ervan laag. Zo wordt de relatie tussen vriespunten van oplossingen; I>II>III
Voorbeeld: Vergelijk kookpunten van de volgende oplossingen;
I. Onverzadigde X vast water-oplossing
II. Verzadigde X vast water oplossing
III. Oververzadigde X vast water-oplossing
Oplossing:
Kookpunt neemt ook toe. Dus III heeft de grootste opgeloste stof erin dan II en uiteindelijk I. De relatie tussen hen wordt; III>II>I
Voorbeeld: De hieronder gegeven containers bevatten oplossingen onder dezelfde temperatuur en druk. Als de molaire concentratie van K+ ion in beide containers gelijk is, welke van de volgende beweringen zijn dan waar voor deze oplossingen?
I. Het aantal mol opgeloste zaken is gelijk.
II. Dampspanning van de eerste container is hoger dan de tweede container.
III. Kookpunt van eerste oplossing is lager dan tweede oplossing.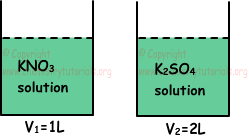
Oplossing:
Neem aan dat, molaire concentratie van [K+]=2 M; I.
1 mol KNO3 omvat 1 mol K+, zo 2 M K+ ion komt uit 2 M KNO3 .
1 mol K2SO4 omvat 2 mol K+, zo 2 M K+ ion komt uit 1 M K2SO4. Dus, mol opgelost KNO3 en K2SO4;
nKNO3=V1.M1=1.2=2 mol
nK2SO4=V2.M2=2.1=2 mol
Het aantal mol opgeloste zaken is dus gelijk, dat is waar.
II. 2M KNO3 geeft 4M ion en 1M K2SO4 geeft 3M ion. Dampspanning is omgekeerd evenredig met de molaire concentratie van deeltjes in oplossing. Aldus is de dampspanning van de tweede houder hoger dan de eerste houder. II is fout.
III. Het kookpunt is recht evenredig met de molaire concentratie van deeltjes in de oplossing. III is onjuist.